
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得。工艺流程如下图:
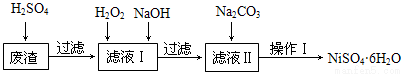
已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示。
Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
Ksp | 8.0×10—16 | 4.0×10—38 | 6.0×10—31 | 6.5×10—18 |
完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
注:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有 。
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是 (用离子方程式表示);
加入NaOH调节pH的范围是 ,为了除去溶液中的 离子。
(3)滤液Ⅱ的主要成分是 。
(4)检验Ni2+已完全沉淀的实验方法是 。
(5)操作Ⅰ的实验步骤依次为:
① ;
② ;
③蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干。
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:2016届辽宁省高三上学期第二次模拟测试化学试卷(解析版) 题型:选择题
在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+ 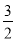 O2(g) = SO2(g)+H2O(g) △H 1
O2(g) = SO2(g)+H2O(g) △H 1
②2H2S(g)+SO2(g) =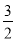 S2(g)+2H2O(g) △H 2
S2(g)+2H2O(g) △H 2
③H2S(g)+ O2(g) = S(g)+H2O(g) △H 3
O2(g) = S(g)+H2O(g) △H 3
④S(g) = 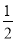 S2(g) △H4
S2(g) △H4
则△H 4的正确表达式为
A.△H 4 =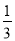 (3△H 3 - △H 1 - △H 2)
(3△H 3 - △H 1 - △H 2)
B. △H 4 = (△H 1 + △H 2 - 3△H 3)
(△H 1 + △H 2 - 3△H 3)
C.△H 4 =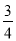 (△H 1 + △H 2 - 3△H 3)
(△H 1 + △H 2 - 3△H 3)
D.△H 4 =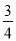 (△H 1 - △H 2 - 3△H 3)
(△H 1 - △H 2 - 3△H 3)
查看答案和解析>>
科目:高中化学 来源:2015-2016河北石家庄第一中学高二上期中考试化学试卷(解析版) 题型:填空题
某烃A的相对分子质量为84。回答下列问题:
(1)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不相等的是(填序号) 。a.C7H12O2 b.C6H14 c.C6H14O d.C7H14O3
(2)若烃A为链烃,与HBr加成后只能得到一种产物,且该烃的一氯代物只有一种。
①A的结构简式为________________;名称是 。
②A在一定条件下能发生加聚反应,写出该反应的化学方程式 。
③A与足量的溴水反应生成B,B与NaOH的醇溶液共热可以得到D,B和D的相对分子质量满足M(D)+81=M(B)。则D分子中含有的官能团有 (填名称)。
(3)若核磁共振氢谱显示链烃A中有三个峰,且峰面积比为3:2:1。写出A所有可能的结构简
式 (包括顺反异构)。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是 ( )
 A.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液:
A.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液: Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B.向NaAlO2溶液中加盐酸至溶液呈酸性:A1O2-+4H+=Al3++2H2O
C.向碳酸氢铵溶液中加入过量的NaOH溶液:HCO3-+OH-=CO32-+H2 O
D.Cl2与H2O反应:Cl2+H2O=2H++Cl-+C1O-
查看答案和解析>>
科目:高中化学 来源:2016届辽宁沈阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列叙述错误的是( )
①热稳定性:H2O>HF>H2S
②密度:K<Na<Rb
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④HCl的形成过程: +
+ →
→
⑤元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑥结合质子的能力:S2->Cl-
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N
A.①②④⑤ B.③⑤⑥⑦ C.②④⑤⑥ D.①③④⑦
查看答案和解析>>
科目:高中化学 来源:2016届湖南师范大学附属中学高三上月考(四)化学试卷(解析版) 题型:实验题
SO2是常见的大气污染物,燃煤是产生SO2的主要原因。工业上有多种方法可以减少SO2的排放。
(1)往煤中添加一些石灰石,可使燃煤过程中产生的SO2转化成硫酸钙。该反应的总化学方程式是___________________________________。
(2)可用多种溶液做燃煤烟气中SO2的吸收液。
①分别用等物质的量浓度的Na2SO3溶液和NaOH溶液做吸收液,当生成等物质的量NaHS03时,两种吸收液体积比V(Na2SO3): V(NaOH)= 。
②NaOH溶液吸收了足量的:SO2后会失效,可将这种失效的溶液与一定量的石灰水溶液充分反应后过滤,使NaOH溶液再生,再生过程的离子方程式是 。
(3)甲同学认为BaCl2溶液可以做SO2的吸收液。为此甲同学设计如下实验(夹持装置和加热装置略,气密性已检验)。反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B中有白色沉淀。甲同学认为B中白色沉淀是SO2与BaCl2溶液反应生成的BaSO3,所以BaCl2溶液可做SO2 吸收液。
吸收液。
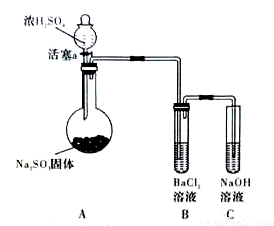
乙同学认为B中的白色沉淀是BaSO4,产生BaSO4的原因是:
①A中产生的白雾是浓硫酸的酸雾,进入B中与BaCI2溶液反应生成BaSO4沉淀。
② 。
为证明 SO2与BaCl2溶液不能得到BaSO3沉淀,乙同学对甲同学的实验装置做了如下改动并实验(夹持装置和加热装置略,气密性已检验):
SO2与BaCl2溶液不能得到BaSO3沉淀,乙同学对甲同学的实验装置做了如下改动并实验(夹持装置和加热装置略,气密性已检验):
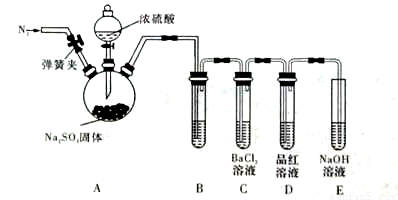
反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B、C试管中除了有气泡外,未见其它现 象;D中红色褪去。
象;D中红色褪去。
③试管B中试剂是 溶液;滴加浓硫酸之前的操作是 。
④通过甲、乙两位同学的实验,得出的结论是 。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省株洲市高三上学期期中化学试卷(解析版) 题型:选择题
氮化铝(AlN)是一种新型无机材料,广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。已知AlN可与NaOH溶液反应放出有刺激性气味的气体。下列叙述正确的是
2AlN+3CO合成。已知AlN可与NaOH溶液反应放出有刺激性气味的气体。下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1molAlN需转移6mol电子
C.AlN属于离子化合物,其中氮元素的化合价为+3
D.AlN与NaOH溶液反应的化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑
查看答案和解析>>
科目:高中化学 来源:2016届湖南长沙市三上学期第四次月考化学试卷(解析版) 题型:填空题
(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g)  HCOOCH3(g)+2H2(g) △H>O
HCOOCH3(g)+2H2(g) △H>O
第二步:HCOOCH3(g)  CH3OH(g)+CO(g) △H>O
CH3OH(g)+CO(g) △H>O
第一步反应的机理可以用图1表示,中间产物X的结构简式为___________。
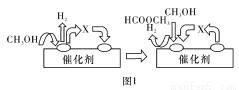

(2)为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X-射线衍射谱图如图2所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为:_____________。
(3)某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4、(沸点43℃),并在180℃时使Ni(CO)4重新分解产生镍单质。上述两步中消耗CO的物质的量之比为______________。
(4)为安全起见,工业生产中需对空气中的CO进行监测。使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图3 所示。这种传感器利用原电池原理,则该电池的负极反应式为:_____________________。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁抚顺第一中学高三上第一次模拟考试化学试卷(解析版) 题型:选择题
某可逆反应的△H=+146kJ/mol,下列关于该反应的叙述正确的是
A.正反应的活化能比逆反应的活化能大146kJ/mol
B.正反应的活化能一定小于146kJ/mol
C.逆反应的活化能一定大于146kJ/mol
D.逆反应的活化能一定大于正反应的活化能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com