
Ⅰ.在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,
已知a+b=12,则:
该温度下,水的离子积常数Kw= 。
‚该温度下,将10mL 0.1mol/L的稀硫酸与10mL 0.4mol/L的NaOH溶液混合后,溶液的pH= ,此时该溶液中由水电离的c(OH-)= mol/L。(忽略体积变化)
Ⅱ. 根据2CrO42-(黄)+2H+ =====Cr2O72-(橙)+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,电解一段时间后,右边溶液逐渐由黄色变为橙色。图中右侧电极连接电源的 极,其电极反应式为
,通电完成后,若转移0.1mol电子,则阴极区和阳极区的质量差为 g。(已知电解前两极区溶液质量相同)

科目:高中化学 来源: 题型:
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
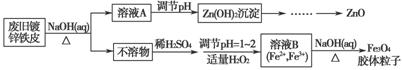
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有________。
A.去除油污
B.溶解镀锌层
C.去除铁锈
D.钝化
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是______________________________________________________________。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是_________________________________________________________。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7(保留4位有效数字,已知MK2Cr2O7=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平 ②烧杯 ③量筒
④玻璃棒 ⑤容量瓶 ⑥胶头滴管
⑦移液管
(5)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与氢键无关的是( )
A.液态氟化氢中有三聚氟化氢(HF)3分子存在 B.冰的密度比液态水的密度小
C.乙醇能与水以任意比混溶而甲醚(CH3—O—CH3)难溶于水 D.H2O比H2S稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,相同物质的量浓度下列溶液中,水的电离程度由大到小排列顺序正确的是( )
①KNO3 ②NaOH ③CH3COONH4 ④NH4Cl
A.③>④>①>② B.④>③>①>②
C.③>④>②>① D.①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
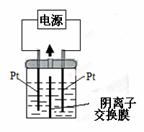
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-==IO3-+5I-+3H2O,下列说法不正确的是 ( )
A.电源右侧为负极
B.右侧发生的电极方程式:2H++2e-==H2↑
C.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
D.电解槽内发生反应的总化学方程式KI+3H2OKIO3+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
医学界通过用放射性14C标记的C60,发现C60的羧酸衍生物在特定条件下可断裂DNA杀死细胞,抑制艾滋病。关于14C的下列说法中正确的是 ( )
A.14C原子与C60中普通碳原子的化学性质相同 B.14C原子与14N原子所含中子数相同
C.14C是C60的同素异形体
D.14CO与12CO、13CO是碳元素的三种同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
100 mL 6 mol·L-1H2SO?4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的 ( )
A.Na2CO3固体 B.NaCl溶液 C.浓H2SO4 D.KNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X和Y元素周期素中处于相邻周期,两种元素原子的质子数之和为21,Y元素原子的核外电子数比X元素原子的核外电子数多5。则下列叙述不正确的是
A.X和Y两元素形成的化合物在熔融状态下电解可以得到两元素的单质
B.Y元素的单质不能和金属氧化物反应
C.X和Y能构成一种阴离子,这种阴离子与过量H+反应可以转变为Y元素的阳离子
D.X元素的一种单质能效地吸收太阳光线中的紫外线
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为__________。
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为__________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为____________。
(4)相同条件下,体积比为a∶b和质量比为a∶b的H2和O2的混合气体,其平均相对分子质量分别是____________和____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com