
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
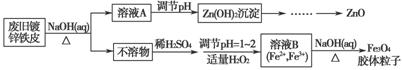
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有________。
A.去除油污
B.溶解镀锌层
C.去除铁锈
D.钝化
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是______________________________________________________________。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是_________________________________________________________。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7(保留4位有效数字,已知MK2Cr2O7=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平 ②烧杯 ③量筒
④玻璃棒 ⑤容量瓶 ⑥胶头滴管
⑦移液管
(5)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将________(填“偏大”“偏小”或“不变”)。
【解析】 (1)由于Zn的性质与Al的相似,可溶于NaOH溶液,因此用NaOH溶液处理废旧镀锌铁皮,除去表面的油污后,可将镀层锌溶解。
(2)调节溶液A的pH产生Zn(OH)2沉淀,然后过滤、洗涤、灼烧使Zn(OH)2分解为ZnO。考虑Zn(OH)2与Al(OH)3的性质相似,应为絮状沉淀物,过滤速度较慢,这里可采用抽滤,加快过滤速度。
(3)溶液B中含有Fe2+、Fe3+,加入NaOH溶液、加热,可得Fe3O4胶体粒子,其中Fe2+极易被氧化成Fe3+,持续通入N2的目的是防止Fe2+被氧化。
(4)称取K2Cr2O7的质量为m(K2Cr2O7)=0.010 00 mol·L-1×0.250 0 L×294.0 g·mol-1=0.735 0 g。用固体配制溶液,要用电子天平称量固体质量,并在烧杯中溶解,然后转移到容量瓶中,不需要量取液体的量筒和移液管。
(5)若滴定前装有K2Cr2O7溶液的滴定管尖嘴部分有气泡,滴定结束时气泡消失,则滴定过程中读取K2Cr2O7溶液的体积偏大,测得Fe3O4中二价铁的含量偏大。
【答案】 (1)AB
(2)抽滤或过滤、洗涤、灼烧
(3)N2气氛下,防止Fe2+被氧化
(4)0.735 0 ③⑦
(5)偏大


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
卤族元素包括F、Cl、Br、I等。
(1)HClO分子中Cl原子上的孤电子对数为 。
(2)KClO3中阴离子的空间构型是 。
(3)HClO4酸性比HClO3酸性强,理由是 。
(4)HX中最不稳定的是 (填化学式),请从结构的角度解释原因
。
(5)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:______C+________K2Cr2O7+________——________CO2↑+________K2SO4+________Cr2(SO4)3+________H2O。
①完成并配平上述化学方程式。
②在上述化学方程式上标出该反应电子转移的方向与数目。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是_________________________________________________________。
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图(a)所示,该电池反应的离子方程式为________________________________________。
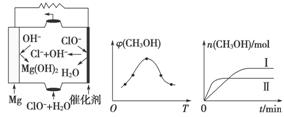
(a) (b) (c)
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH。
①该反应的平衡常数表达式为K=________。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图(b)所示,则上述CO2转化为甲醇反应的ΔH________(填“>”“<”或“=”)0。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图(c)所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中各组物质不能实现如图转化的是( )

| 选项 | 甲 | 乙 | 丙 |
| A | AlCl3 | Al | Al(OH)3 |
| B | AlCl3 | Al(OH)3 | NaAlO2 |
| C | CO2 | NaHCO3 | Na2CO3 |
| D | CO2 | (NH4)2CO3 | NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是( )
A.用石墨作电极电解CuCl2溶液:2Cl-+2H2O  Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.用Na2CO3溶液作洗涤剂除油污:CO +2H2OH2CO3+2OH-
+2H2OH2CO3+2OH-
C.硫酸亚铁溶液与稀硫酸、双氧水混合:Fe2++2H2O2+4H+===Fe3++4H2O
D.向NaAlO2溶液中通入过量的CO2:AlO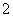 +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO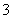
查看答案和解析>>
科目:高中化学 来源: 题型:
如图甲池和乙池中的四个电极都是惰性材料,请根据图示判断下列说法正确的是( )

A.两个装置之间没有盐桥,故不能形成电流
B.a电极的电极反应式:C2H5OH+16OH--12e-===2CO +11H2O
+11H2O
C.一段时间后,乙池d电极周围的溶液呈现棕褐色
D.乙池在反应前后溶液的pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
某+2价离子的电子排布式为1s22s22p63s23p63d9,该元素在周期表中所属族 ( )
A. IIA B. IIB C. VIII D. IB
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,
已知a+b=12,则:
该温度下,水的离子积常数Kw= 。
‚该温度下,将10mL 0.1mol/L的稀硫酸与10mL 0.4mol/L的NaOH溶液混合后,溶液的pH= ,此时该溶液中由水电离的c(OH-)= mol/L。(忽略体积变化)
Ⅱ. 根据2CrO42-(黄)+2H+ =====Cr2O72-(橙)+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,电解一段时间后,右边溶液逐渐由黄色变为橙色。图中右侧电极连接电源的 极,其电极反应式为
,通电完成后,若转移0.1mol电子,则阴极区和阳极区的质量差为 g。(已知电解前两极区溶液质量相同)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com