
卤族元素包括F、Cl、Br、I等。
(1)HClO分子中Cl原子上的孤电子对数为 。
(2)KClO3中阴离子的空间构型是 。
(3)HClO4酸性比HClO3酸性强,理由是 。
(4)HX中最不稳定的是 (填化学式),请从结构的角度解释原因
。
(5)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是 。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
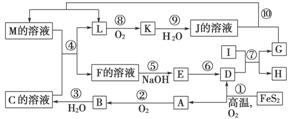
提示:4FeS2+11O2高温,2Fe2O3+8SO2
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第________周期________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为________。
(3)在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是________(填序号)。
(4)反应④的离子方程式是_____________________________________。
(5)将化合物D与KNO3、KOH共熔,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是
______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
A a为负极、b为正极 B a为阳极、b为阴极
C 电解过程中,d电极质量增加 D 电解过程中,氯离子浓度不变

查看答案和解析>>
科目:高中化学 来源: 题型:
食盐主要成分是NaCl,还含有SO42-等其他可溶性杂质离子。下列说法不正确的是
A.除去SO42- 最合适的试剂是BaCl2
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.室温下,AgCl在水中的溶解度大于在食盐水中的溶解度
D.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
C、N、S的单质和化合物在工农业生产中有重要的应用。
(1)甲烷为原料制取氢气是工业上常用的制氢方法。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
则CH4(g)+2H2O(g) =CO2(g) +4H2(g) △H= 。
(2)工业上可采用下列反应合成甲醇:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0
CH3OH(g)+H2O(g) △H<0
若容器容积不变,下列措施可增加氢气转化率的是 。
A.升高温度 B.增加CO2的量
C.充入He,使体系总压强增大 D.按原比例再充入CO2和H2
 (3)氨气、次氯酸钠按一定物质的量之比混合反应可制的联氨。写出该反应的化学方程式 。
(3)氨气、次氯酸钠按一定物质的量之比混合反应可制的联氨。写出该反应的化学方程式 。
(4)某联氨—氧气—氢氧化钾溶液燃料电池如图所示电池工作时,OH—向U型管 (填“左”或“右”)侧定向移动,正极的电极反应式为 。
(5)某温度下反应2SO2(g)+O2(g) 2SO3(g)的K=1620
2SO3(g)的K=1620
在1L的密闭容器中,充入0.2molSO2、0.1molO2和1.8mol SO3。则此时该反应 (填“向正反应进行”或“向逆反应进行”或“已平衡”)
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列溶液中,各组离子一定能够大量共存的是( )
A.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br-
B.常温下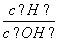 =1012的溶液:Fe2+、Mg2+、NO
=1012的溶液:Fe2+、Mg2+、NO 、Cl-
、Cl-
C.含有大量Al3+的溶液:Na+、Cl-、AlO 、OH-
、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO 、S2-、SO
、S2-、SO
查看答案和解析>>
科目:高中化学 来源: 题型:
已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用如图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )

A.①② B.②
C.②③ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
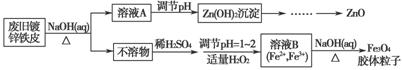
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有________。
A.去除油污
B.溶解镀锌层
C.去除铁锈
D.钝化
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是______________________________________________________________。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是_________________________________________________________。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7(保留4位有效数字,已知MK2Cr2O7=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平 ②烧杯 ③量筒
④玻璃棒 ⑤容量瓶 ⑥胶头滴管
⑦移液管
(5)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与氢键无关的是( )
A.液态氟化氢中有三聚氟化氢(HF)3分子存在 B.冰的密度比液态水的密度小
C.乙醇能与水以任意比混溶而甲醚(CH3—O—CH3)难溶于水 D.H2O比H2S稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com