
| A. | ①②⑥⑦ | B. | ②④⑥ | C. | ①⑤⑥⑦ | D. | ①②⑥ |
分析 ①甲烷为天然气的主要成分,光照下与氯气等能发生取代反应;
②乙烯为一个国家石油化工发展水平的标志,含碳碳双键可以发生加成反应;
③苯为平面结构,不含碳碳双键;
④油脂的相对分子质量在10000以下;
⑤淀粉为多糖,遇碘单质变蓝色;
⑥糖类、油脂、蛋白质均为人类必需的营养物质;
⑦碳纤维为C的单质,光导纤维的成分为二氧化硅.
解答 解:①甲烷为天然气的主要成分,光照下与氯气等能发生取代反应,如甲烷与氯气发生取代反应生成氯代烃,故正确;
②乙烯为一个国家石油化工发展水平的标志,含碳碳双键可以发生加成反应,如乙烯与溴水发生加成反应,故正确;
③苯为平面结构,不含碳碳双键,为介于单键与双键之间特殊的化学键,故错误;
④油脂的相对分子质量在10000以下,不是高分子,但可水解,故错误;
⑤淀粉为多糖,遇碘单质变蓝色,不是碘元素,故错误;
⑥糖类、油脂、蛋白质均为人类必需的营养物质,为人类生命活动提供能量,故正确;
⑦碳纤维为C的单质,光导纤维的成分为二氧化硅,均为无机材料,只有聚酯纤维为有机高分子材料,故错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物的组成、性质及反应,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | B、D的最高价氧化物中,B、D与氧原子都形成离子键 | |
| B. | 四种元素的原子半径:A<B<C<D | |
| C. | D元素位于元素周期表中的第三周期第ⅣA族 | |
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据反应Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑可推出Cu的还原性比H2的强 | |
| B. | 在反应CaH2+2H2O═Ca(OH)2+2H2↑中,水作氧化剂 | |
| C. | 反应3NO2+H2O═2HNO3+NO中氧化剂和还原剂的物质的量之比是3:1 | |
| D. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
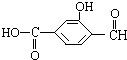 具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如图具有三个官能团:-COOH、酚-OH和-CHO,所以这个化合物可看作羧酸类,酚类和醛类.
具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如图具有三个官能团:-COOH、酚-OH和-CHO,所以这个化合物可看作羧酸类,酚类和醛类.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A-x-n | B. | A-x+n | C. | A+x-n | D. | A+x+n |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C14H18O5 | B. | C14H16O4 | C. | C14H22O3 | D. | C14H10O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.02mol/(L•s) | B. | 0.04mol/(L•s) | C. | 0.06mol/(L•s) | D. | 0.03mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com