
实验:①向盛有1 mL 0.1 mol/L MgCl2溶液试管中加1 mL 0.2 mol/L NaOH溶液,得到浊液a,过滤得到滤液b和白色沉淀c。②向沉淀c中滴加0.1mol/LFeCl3溶液,沉淀变为红褐色。下列分析不正确的是
A、浊液a中存在沉淀溶解平衡:Mg (OH) 2(s) Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)
B、滤液b中不含有Mg2+
C、②中颜色变化说明Mg (OH)2转化为Fe(OH)3
D、实验可以证明Fe(OH)3比Mg (OH)2更难溶
B
【解析】①向盛有1 mL 0.1 mol/L MgCl2溶液试管中加1 mL 0.2 mol/L NaOH溶液,恰好发生反应:MgCl2+2NaOH=Mg(OH) 2↓+2NaCl。Mg(OH) 2在溶液中存在沉淀溶解平衡Mg (OH) 2(s) Mg2+(aq)+2OH-(aq)。所以得到浊液a中含有Mg(OH) 2、NaCl、及Mg(OH) 2溶液,过滤得到滤液b中含有Mg2+、OH-、Na+、Cl-。和白色沉淀c Mg (OH) 2。②向沉淀c中滴加0.1mol/L FeCl3溶液,由于在溶液中存在沉淀溶解平衡Mg (OH) 2(s)
Mg2+(aq)+2OH-(aq)。所以得到浊液a中含有Mg(OH) 2、NaCl、及Mg(OH) 2溶液,过滤得到滤液b中含有Mg2+、OH-、Na+、Cl-。和白色沉淀c Mg (OH) 2。②向沉淀c中滴加0.1mol/L FeCl3溶液,由于在溶液中存在沉淀溶解平衡Mg (OH) 2(s) Mg2+(aq)+2OH-(aq),Fe3++3OH-=Fe(OH)3↓。破坏了Mg(OH) 2的沉淀溶解平衡,使沉淀溶解平衡正向移动,结果白色沉淀逐渐溶解变为红褐色沉淀,发生沉淀的转化。因此错误的说法是B。
Mg2+(aq)+2OH-(aq),Fe3++3OH-=Fe(OH)3↓。破坏了Mg(OH) 2的沉淀溶解平衡,使沉淀溶解平衡正向移动,结果白色沉淀逐渐溶解变为红褐色沉淀,发生沉淀的转化。因此错误的说法是B。


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:选择题
下列说法错误的是
A.1个 C3H8分子中的共价键总数为10
B.除去苯中含有的少量溴可以加入NaOH溶液,然后蒸馏出苯
C.可用溴的四氯化碳溶液除去丙烷中的丙烯
D.某聚乙烯单链分子的相对分子质量为519766,则该聚乙烯单链分子的聚合度为19991
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:简答题
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为______________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为_______________、_______________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_______________;
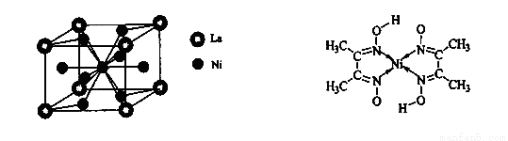
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是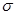 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
②该结构中,氧氢之间除共价键外还可存在_______________;
③该结构中,碳原子的杂化轨道类型有_______________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:简答题
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。
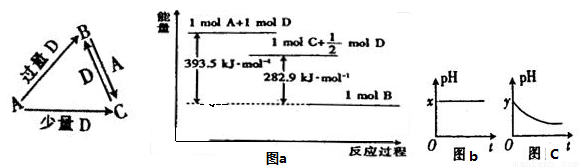
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为 ;
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则
①C的化学式为 ;
②反应B+A→C的离子方程式为 ;
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D的化学式为 ;
②若图c符合事实,则其pH变化的原因是 (用离子方程式表示);
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式 ;
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
下列离子方程式的书写与结论均合理的是
选项 | 离子方程式 | 结论 |
A | AgCl(s) + I-( aq) | 溶解度:AgI > AgCl |
B | Fe2++ H2O2 +2H+= Fe3++2H2O | 氧化性:H2O2 > Fe3+ |
C | CO32- + CO2 + H2O = 2HCO3- | 稳定性:HCO3- > CO32- |
D | NH3 + H3O+=NH4++ H2O | 得质子能力:NH3 > H2O |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
下列药品和装置合理且能完成相应实验的是
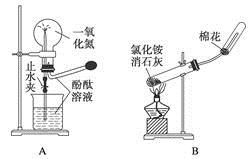
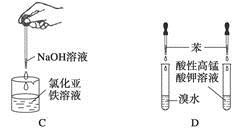
A.喷泉实验
B.实验室制取并收集氨气
C.制备氢氧化亚铁
D.验证苯中是否有碳碳双键
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
500 mL NaNO3和Cu(NO3)2的混合溶液中c( NO3- )=0.3 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体1.12 L(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(Na+)=0.2 mol·L-1
B.电解后溶液中c(H+)=0.2 mol·L-1
C.上述电解过程中共转移0.4 mol电子
D.电解后得到的Cu的物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:选择题
常温下,下列各组离子在指定的溶液中可能大量共存的是
A.无色透明溶液中:Al3+、Ca2+、Cl-、HCO3-
B.含大量Fe3+的溶液中:K+、I-、SO42-、NO3-
C.与Al反应放出H2的溶液中:NH4+、Na+、NO3-、F-
D.由水电离出的c(H+)=1.0×10-14 mol·L-1的溶液中:Mg2+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:实验题
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与硫酸反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定,以下实验过程不完整,请补充完整。

(1)按上图组装仪器,并______________________________________________;
(2)将8.0 g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
(3)从左端导气管口处不断地缓缓通入H2,____________________________,
点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,________________________________________;
(5)测得反应后装置B增重2.25 g,则铁矿石中氧的百分含量为________。
Ⅱ.铁矿石中含铁量的测定,流程如下。
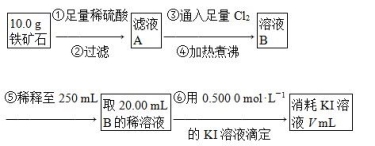
(1)步骤④中煮沸的作用是___________________________________________。
(2)步骤⑤中用到的玻璃仪器有烧杯、胶头滴管、250 mL容量瓶、________。
(3)下列有关步骤⑥的操作中说法正确的是________。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.锥形瓶不需要用待测液润洗
c.滴定过程中可利用淀粉溶液作指示剂
d.滴定过程中,眼睛注视滴定管中液面变化
e.滴定结束后,30 s内溶液不恢复原来的颜色,再读数
f.滴定结束后,滴定管尖嘴部分有气泡,则测定结果偏大
(4)若滴定过程中消耗0.500 0 mol·L-1 KI溶液20.00 mL,则铁矿石中铁的百分含量为________。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com