
【题目】工业上可用CO2和H2反应合成甲醇。
已知25°C、101 kPa下:
H2(g)+1/2O2(g)=H2O (g) △H1= - 242kJ/mol
CH3OH(g)+3/2O2(g) =CO2(g)+2H2O(g) △H2= - 676kJ/mol
(1)写出CO2与H2反应生成CH3OH(g)与H2O (g)的热化学方程式_________________。常温下,某实验中将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图曲线 (甲)所示。请完成下列问题:
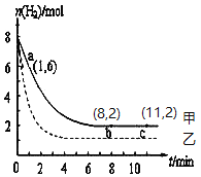
(2)该反应能在________(填“高温”或“低温”)条件下自发进行;从a点到b点,用H2表示该反应的平均化学反应速率是____________。(保留两位有效数字),a点逆反应速率_____b点逆反应速率(填“>”、“<”或“=”);达平衡时,CO2的转化率是_____。
(3)若仅改变某一实验条件再进行一次实验,测得H2的物质的量随时间变化如图中虚线(乙)所示,曲线(乙)对应改变的实验条件可以是________(填序号)。
a.加催化剂 b.增大压强 c.升高温度 d.增大H2浓度
(4)若曲线甲b点达到平衡时体系压强为100MPa,此时H2的平衡分压为_______MPa。(某物质分压=总压×某物质的物质的量分数)
(5)下列叙述能标志该反应达到化学平衡状态的是_________
a.CO2与H2的转化率之比不变 b.υ(生成H2) : υ(消耗H2O) = 3:1
c.混合气体的相对分子质量不变 d.甲醇与水蒸气的分压比不变
【答案】CO2(g)+3H2(g) =CH3OH(g)+H2O(g) ΔH= -50 kJ/mol 低温 0.28mol/(L·min) < 33.3% b 20 ac
【解析】
(1)根据盖斯定律对已知热化学方程式进行加合运算。
(2) 由CO2(g)+3H2(g)=CH3OH(g)+H2O(g) 的ΔH、ΔS的正负,再根据ΔH-TΔS<0时反应才能自发进行,确定该反应自发进行的温度条件。由图像分析,初始只投入了反应物,从正反应开始,第8min后反应已处于平衡状态,根据反应速率公式![]() =
=![]() 计算H2的平均反应速率。根据逆反应速率受生成物浓度影响分析a、b两点逆反应速率的相对大小。最后根据转化率概念计算CO2的转化率。
计算H2的平均反应速率。根据逆反应速率受生成物浓度影响分析a、b两点逆反应速率的相对大小。最后根据转化率概念计算CO2的转化率。
(3)从图像分析,再一次实验时起始投料不变,达到平衡所需要的时间缩短,平衡时H2的物质的量比甲曲线小,表明平衡向正反应方向移动。由此分析。
(4)根据相关数据先计算H2平衡时物质的量分数,再根据“某物质分压=总压×某物质的物质的量分数”得到H2的平衡分压。
(5)根据化学平衡状态的特征分析。
(1)给已知的热化学方程式编号①H2(g)+![]() O2(g)=H2O (g) △H1= - 242kJ/mol。②CH3OH(g)+
O2(g)=H2O (g) △H1= - 242kJ/mol。②CH3OH(g)+![]() O2(g) =CO2(g)+2H2O(g) △H2= - 676kJ/mol。根据盖斯定律,将①×3-②得:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=(- 242kJ/mol)×3-(- 676kJ/mol)= -50 kJ/mol。即所求的热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-50 kJ/mol。
O2(g) =CO2(g)+2H2O(g) △H2= - 676kJ/mol。根据盖斯定律,将①×3-②得:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=(- 242kJ/mol)×3-(- 676kJ/mol)= -50 kJ/mol。即所求的热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-50 kJ/mol。
(2) 由反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-50 kJ/mol可知,该反应ΔH<0,ΔS<0,因为只有当ΔH-TΔS<0时该反应才能自发进行,因此只有T值较小时(即低温)下才可能自发进行。由图像知从a点到b点过程中Δc(H2)=![]() -
-![]() =2mol/L,Δt=8min-1min=7min,则用H2表示该反应的平均反应速率
=2mol/L,Δt=8min-1min=7min,则用H2表示该反应的平均反应速率![]() =
=![]() =
=![]() =0.28mol/(L·min)。反应开始时生成物浓度为0,逆反应速率为最小,反应开始后生成物浓度逐渐增大,逆反应速率逐渐增大,所以a、b两点逆反应速率大小关系为:a<b。由图像可知b、c两点处于平衡状态,平衡时H2的物质的量为2mol,参加反应的H2的物质的量Δn(H2)=8mol-2mol=6mol,根据反应方程式计量数得CO2的转化量Δn(CO2)=
=0.28mol/(L·min)。反应开始时生成物浓度为0,逆反应速率为最小,反应开始后生成物浓度逐渐增大,逆反应速率逐渐增大,所以a、b两点逆反应速率大小关系为:a<b。由图像可知b、c两点处于平衡状态,平衡时H2的物质的量为2mol,参加反应的H2的物质的量Δn(H2)=8mol-2mol=6mol,根据反应方程式计量数得CO2的转化量Δn(CO2)=![]() ·Δn(H2)=
·Δn(H2)= ![]() ×6mol=2mol,所以达平衡时CO2的转化率=
×6mol=2mol,所以达平衡时CO2的转化率=![]() ×100%=
×100%=![]() ×100%=33.3%。
×100%=33.3%。
(3)分析图像可知,再一次实验的初始投料相同,达到平衡所用时间缩短,平衡向正反应方向移动。a.催化剂不会使平衡移动,a项错误;b.对于有气体参加的反应,增大压强,反应速率增大,平衡向气体体积减小的方向移动,所以增大压强,该反应达到平衡所用时间缩短,平衡向正反应方向移动,b项正确;c.升高温度平衡向吸热反应方向移动,即该反应向逆反应方向移动,c项错误;d.由图像知初始时H2的浓度没有变化,d项错误;答案选b。
(4)曲线甲的b点达到平衡时H2的物质的量为2mol,由“三段式”分析如下:
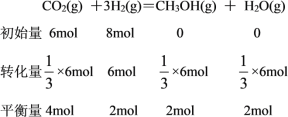
平衡时H2的物质的量分数=![]() ×100%=20%,则H2的平衡分压=100MPa×20%=20MPa。
×100%=20%,则H2的平衡分压=100MPa×20%=20MPa。
(5)a. 由反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)可知,反应过程中CO2和H2转化量之比=1:3,但初始时CO2和H2的物质的量之比=6mol:8mol=3:4≠1:3,因此反应过程中CO2和H2的转化率之比≠1:3,且一直在变化,只有达到平衡状态时CO2和H2的转化率之比才不变,所以CO2与H2的转化率之比不变,能标志该反应达到化学平衡状态,a项正确;b.υ(生成H2)表示逆反应速率,υ(消耗H2O)也表示逆反应速率,不能确定此时反应是否达到化学平衡状态。所以υ(生成H2) : υ(消耗H2O) = 3:1,不能标志该反应达到化学平衡状态,b项错误;c.根据质量守恒,反应过程中混合气体总质量(m总)不变,由反应方程式知,在反应过程中混合气体的总物质的量(n总)一直减小,根据混合气体的相对分子质量公式![]() =
=![]() 可推知,混合气体的相对分子质量在反应过程中一直在变化,只有达到平衡状态时才不变,所以混合气体的相对分子质量不变,能标志该反应达到化学平衡状态,c项正确;d.根据“某物质分压=总压×某物质的物质的量分数”可知,物质分压与对应组分的物质的量成正比,由反应方程式计量数知,生成甲醇与水蒸气的物质的量之比一直等于1:1,因此反应过程中甲醇与水蒸气的分压比一直不变,所以甲醇与水蒸气的分压比不变,不能标志该反应达到化学平衡状态,d项错误;答案选ac。
可推知,混合气体的相对分子质量在反应过程中一直在变化,只有达到平衡状态时才不变,所以混合气体的相对分子质量不变,能标志该反应达到化学平衡状态,c项正确;d.根据“某物质分压=总压×某物质的物质的量分数”可知,物质分压与对应组分的物质的量成正比,由反应方程式计量数知,生成甲醇与水蒸气的物质的量之比一直等于1:1,因此反应过程中甲醇与水蒸气的分压比一直不变,所以甲醇与水蒸气的分压比不变,不能标志该反应达到化学平衡状态,d项错误;答案选ac。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Fritz Haber在合成氨领域的贡献距今已经110周年,氮族元素及其化合物应用广泛。
(1)在基态13N原子中,核外存在__________对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为__________形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是________,与NO3-互为等电子体的分子为__________。液氨中存在电离平衡2NH3![]() NH4++NH2-,根据价层电子对互斥理论,可推知NH2-的空间构型为__________,液氨体系内,氮原子的杂化轨道类型为________。NH3比PH3更容易液化的原因为__________________。
NH4++NH2-,根据价层电子对互斥理论,可推知NH2-的空间构型为__________,液氨体系内,氮原子的杂化轨道类型为________。NH3比PH3更容易液化的原因为__________________。
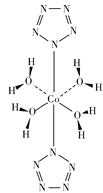
(3)我国科学工作者实现世界首次全氮阴离子(N5-)金属盐Co(N5)2(H2O)4·4H2O的合成,其结构如图所示,可知N5-的化学键类型有______________。
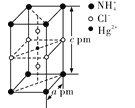
(4)把特定物质的量之比的NH4Cl和HgCl2在密封管中一起加热时,生成晶体X,其晶胞的结构图及晶胞参数如图所示。则晶体X的化学式为__________,其晶体密度为__________(设阿伏加德罗常数的值为NA,列出计算式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两个装置的烧杯中分别盛有足量的CuCl2溶液。
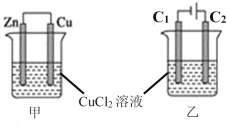
(1)甲装置中,Zn电极发生______反应(填“氧化”或“还原”),溶液中Cl-向_____极(填“Zn”或“Cu”)移动,Zn电极反应式为_______,若反应过程中有0.1mol电子发生转移,则Cu极质量增加__________。
(2)乙装置中,石墨电极C1是_______极,现象是______,C2极电极反应式为_______,若反应过程中阴极析出12.8g的Cu,则阳极产生的气体在标准状况下的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和c(H+)都相等,向两烧杯中同时加入两颗锌粒,反应结束后得到等量的氢气,有一个烧杯中有锌粒剩余。下列说法正确的是
A. 两烧杯中参加反应的锌等量
B. 盐酸物质的量浓度比醋酸大
C. 乙烧杯中的锌粒剩余
D. 甲烧杯的反应时间更短
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某同学为了探究锌与硫酸反应过程中的速率变化,在 400mL 稀硫酸中加入足量的锌粉,标况下用排水集气法收集反应放出的氢气,实验记录如下(累计值):
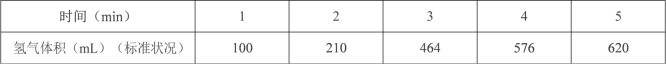
①哪一时间段反应速率最大_______min(填“0~1”、“1~2”、“2~3”、“3~4”、“4~5”), 原因是________。
②求 3~4 分钟时间段以盐酸的浓度变化来表示的该反应速率________设溶液体积不变)。
(2)该同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回 答下列问题:
①硫酸铜溶液可以加快氢气生成速率的原因是_______。
②实验室中现有 Na2SO4、MgSO4、Ag2SO4、K2SO4 等 4 种溶液,可与实验中 CuSO4 溶液起相似作用的是_______。
③要减慢上述实验中气体产生速率,可采取的合力措施有_______、_______(答两种)。
(3) 某温度下在 4 L 密闭容器中,X、Y、Z 三种气态物质的物质的量随时间变化曲线如图。
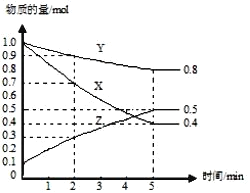
①该反应的化学方程式是_______。
②该反应达到平衡状态的标志是_______(填字母)
A.Y 的体积分数在混合气体中保持不变 B.X、Y 的反应速率比为 3:1
C.容器内气体压强保持不变 D.容器内气体的总质量保持不变E.生成 1 mol Y 的同时消耗 2 mol Z
③2 min 内 Y 的转化率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 胶体与溶液的本质区别在于是否可以发生丁达尔现象
B. 在常温下铁遇浓硫酸会钝化,所以可以用铁制容器来装运浓硫酸
C. 氯气具有漂白性,可以使湿润的有色布条褪色
D. 二氧化碳通入足量澄清石灰水中,没有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种镁-过氧化氢燃料电池的原理为Mg + H2O2 + H2SO4=MgSO4+ 2H2O ,其装置如图所示。下列说法错误的是

A.a极发生还原反应B.电子由b极经电解质溶液流向a极
C.Mg2+由右侧经过阳离子交换膜移向左侧D.b极电极反应式为Mg-2e-=Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量变化说法正确的是

A. 相同条件下,氢气和氧气反应生成液态水比生成等量的气态水所放出的热量少
B. 根据如图金刚石在一定条件下转化成石墨提供的信息,可知生成物比反应物稳定,过程中向外界放出热量为E2-E3
C. 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
D. 已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+489.0kJ·mol-1
CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ·mol-1
C(石墨)+O2(g)=CO2(g)△H=-393.5kJ·mol-1
则4Fe(s)+3O2(g)=2Fe2O3(s)△H=-1641.0kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如下:

将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围:___________________________________。
(2)写出B的化学式:B________。
(3)①H2O2分子的电子式:__________________________________。
②写出C的酸性溶液与双氧水反应的离子方程式:_________________________。
(4)写出鉴定E中阳离子的实验方法和现象:____________________________。
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com