
【题目】一种新型漂白剂结构如图所示,其中W.Y.Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列说法正确的是
![]()
A.非金属性:X>W>Y
B.Y的最高价氧化为对应的水化物为三元酸
C.可利用W与X、Y形成的化合物热还原制备单质Y
D.该漂白剂中仅有X均满足8电子稳定结构
【答案】C
【解析】
由W2+可知,W最外层有2个电子;Z形成1个键,Z是第ⅠA或ⅦA族元素;W、Y、Z的最外层电子数之和等于X的最外层电子数,X形成2个键,X是ⅥA族元素;Z与X形成共价键,Z是H元素,X是O元素;Y是B元素;W、X对应的简单离子核外电子排布相同,W是Mg元素。
A. W是镁,为金属元素,非金属性:O>B>Mg,故A错误;
B. Y是B元素,B的最高价氧化为对应的水化物为H3BO3,H3BO3中的质子无法直接电离出,H3BO3结合水中的OH-,电离出H+,H3BO3是一元弱酸,故B错误;
C. 镁和B2O3加热生成B和氧化镁,故C正确;
D. 该漂白剂中Mg2+、B、O均满足8电子稳定结构,故D错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的![]() 的原子和价电子排布为4s24p5的原子
的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和价电子排布为2s22p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题是人类社会面临的重大问题,合理的开发利用至关重要。
(1)丁烯是石油化工中的重要产物,正丁烷脱氢可制备1-丁烯:C4H10(g) =C4Hg(g) +H2(g) △H。 下表为该反应中所涉及物质的键能数据:
![]()
则△H=_______
(2)甲醇是未来重要的绿色能源之一,常见的合成反应为CO(g) +2H2(g)![]() CH3OH(g)H<0;为了探究反应物的浓度对反应速率的影响,进行了相关实验,测得的实验数据如下表所示:
CH3OH(g)H<0;为了探究反应物的浓度对反应速率的影响,进行了相关实验,测得的实验数据如下表所示:
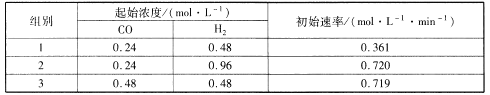
该反应速率的通式为v正=k正cm(CO).cn(H2)(k是与温度有关的速率常数)。由表中数据可确定反应速率通式中m和n分别_____、_____( 取正整数)。
(3)合成甲醇的原料气既可由煤气化提供,也可由天然气与水蒸气通过下列反应制备:CH4(g) + H2O(g) ![]() CO(g) +3H2(g)H>0。向100 L刚性密闭容器中充人1 mol CH4和3 mol水蒸气进行反应,不同温度和压强下平衡体系中CH4的平衡转化率情况如图1所示:
CO(g) +3H2(g)H>0。向100 L刚性密闭容器中充人1 mol CH4和3 mol水蒸气进行反应,不同温度和压强下平衡体系中CH4的平衡转化率情况如图1所示:
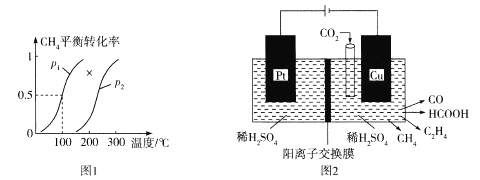
①p1____p2(填“<”“>”或“=")。
②已知压强为P1,温度为100°C时,反应达到平衡所需的时间为5min,则0~5min内用H2表示的平均反应速率为______;该温度下的平衡常数K=_______mol2·L-2。
(4)近年来,有人研究用温室气体二氧化碳通过电催化生成多种燃料,其工作原理如图2所示。
①写出Cu电极上产生乙烯的电极反应式:_____________;如果Cu电极上生成0.17molCO和0.33molHCOOH,则Pt电极上产生O2的物质的量为__________mol。
②HCOOH为一元弱酸,常温下将0.1mol·L-1HCOOH溶液与0.1mol·L-1NaOH溶液按体积比a:b混合(忽略溶液体积的变化),混合后溶液恰好显中性,则HCOOH的电离常数为______(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料,下列关于聚乙炔的叙述错误的是( )
A. 聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B. 聚乙炔的化学式为![]()
C. 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D. 聚乙炔树脂不加任何填充物即可成为电的良导体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:

①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________;
(3)检验淀粉是否水解完全所用的试剂为_________;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利奈唑胺(I)为细菌蛋白质合成抑制剂,其合成路线如下:
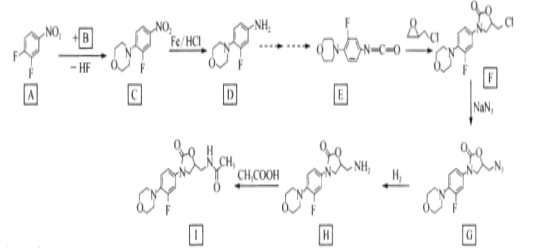
回答下列问题:
(1)A中的官能团名称是____,
(2)C—D、F—G的结反应类型分别为____
(3)B的结构简式为____。
(4)H—I的化学方程式为____。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。用星号(*)标出![]() 中的手性碳____
中的手性碳____
(6)芳香族化合物X是C的同分异构体,写出核磁共振氢谱有4组峰且峰面积比为4:4:2:1的X的结构简式____。(不考虑立体异构,只写一种)
(7)参照上述合成路线,设计以甲苯和乙酸为原料制备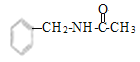 的合成路线(无机试剂任选)____。
的合成路线(无机试剂任选)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通信用磷酸铁锂电池具有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-+Li+=LiM1-xFexPO4,其原理如图所示,下列说法正确的是( )
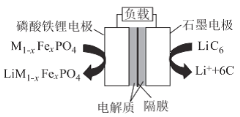
A.电池总反应为M1-xFexPO4+LiC6═LiM1-xFexPO4+6C
B.放电时,负极LiC6中碳元素失去电子变为单质
C.放电时,电流由石墨电极流向磷酸铁锂电极
D.充电时,Li+移向磷酸铁锂电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
磷元素在生产和生活中有广泛的应用。
(1)P原子价电子排布图为__________________________。
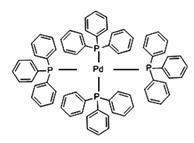
(2)四(三苯基膦)钯分子结构如下图:
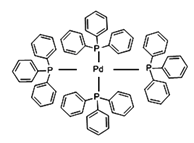
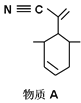
P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为___________;判断该物质在水中溶解度并加以解释_______________________。该物质可用于右上图所示物质A的合成:物质A中碳原子杂化轨道类型为__________________;一个A分子中手性碳原子数目为__________________。
(3)在图示中表示出四(三苯基膦)钯分子中配位键:_____________
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正六面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为_____________________;正四面体形阳离子中键角小于PCl3的键角原因为__________________;该晶体的晶胞如右图所示,立方体的晶胞边长为a pm,NA为阿伏伽德罗常数的值,则该晶体的密度为_______g/cm3。
(5)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1的NaOH溶液滴定20.00mL浓度为0.10mol·L-1的HX溶液所得滴定曲线如下图(忽略溶液体积变化)。下列说法正确的是
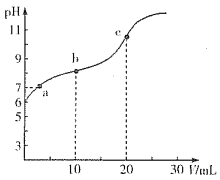
A. 常温下K(HX)≈1×10-12
B. a点所示的溶液中:c(Na+)>c(X-)>c(OH-)=c(H+)
C. c点所示的溶液中:c(Na+)+c(HX)+c(X-)=0.10mol·L-1
D. 相同条件下,X-的水解能力弱于HX的电离能力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com