
| 实验编号 | 起始浓度c(HA) | 起始浓度c(NaOH) | 反应后溶液的pH |
| ① | 0.2mol?L-1 | 0.2mol?L-1 | 9 |
| A、HA是一元强酸 |
| B、反应后溶液中c(A-)>c(Na+) |
C、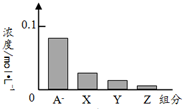 若用如图来表示反应后各微粒的关系,则图中X 表示OH-,Y表示HA,Z表示H+ |
| D、该混合溶液中:c(A-)+c(Y)>c(Na+) |


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
| A、pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B、含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C、0.1 mol/L NH4Cl与0.1 mol/L氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl-)>c(OH-) |
| D、含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸的摩尔质量和6.02×1023个硝酸分子的质量(以克为单位)在数值上相等 |
| B、6.02×10个氮气分子和6.02×1023个氢气分子的质量比等于14:1 |
| C、32g氧气所含的原子数目约为2×6.02×1023 |
| D、通常情况下,近似值6.02×1023就是我们所说的阿伏伽德罗常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| B、向40 mL 8 mol/L的稀硝酸溶液中加入5.6 g铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| C、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
| D、FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、聚丙烯的链节:-CH2-CH2-CH2- | ||
B、NH4Cl的电子式: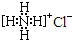 | ||
C、F-结构示意图: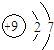 | ||
D、中子数为20的氯原子:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1NaOH溶液与0.2 mol?L-1CH3COOH溶液等体积混合后:c(CH3COOH)+c(CH3COO-)=0.2 mol?L-1 |
| B、常温下,将CH3COONa和HCl两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
| C、pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4溶液,c(NH4+)大小顺序为①=②>③ |
| D、25℃时,pH=a的盐酸与pH=b的Ba(OH)2溶液等体积混合后,恰好完全反应,则a+b=14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
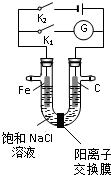
| A、K1闭合,铁棒侧溶液会出现白色沉淀,而且沉淀最终变为红褐色 |
| B、K1或K2闭合,石墨棒周围溶液pH均升高 |
| C、K2闭合,铁棒上发生的反应为2Cl--2e-=Cl2↑ |
| D、K2闭合,电路中通过0.002 NA个电子时,两极共产生0.002mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| B、核外电子排布相同的微粒化学性质也相同 |
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 |
| D、1735 Cl 与 1737 Cl 得电子能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com