
分析 3A(g)+B(g)?xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,则
3A(g)+B(g)?xC(g)+2D(g),
开始(mol/L) 3 3 0 0
转化 3×60% 0.6 1.2
平衡 1.2 2.4 0.6x 1.2
(1)由上述分析可知平衡状态D的浓度;
(2)结合v=$\frac{△c}{△t}$计算;
(3)结合速率之比等于化学计量数之比计算;
(4)开始时容器中的压强与平衡时的压强之比等于反应前后的物质的量之和的比.
解答 解:3A(g)+B(g)?xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,则
3A(g)+B(g)?xC(g)+2D(g),
开始(mol/L) 3 3 0 0
转化 3×60% 0.6 1.2
平衡 1.2 2.4 0.6x 1.2
(1)由上述分析可知平衡状态D的浓度为1.2mol/L,故答案为:1.2mol/L;
(2)B的平均反应速率υ(B)=$\frac{0.6mol/L}{5min}$=0.12mol/( L.min),故答案为:0.12mol/( L.min)
(3)由速率之比等于化学计量数之比可知,$\frac{1}{x}$=$\frac{0.12}{0.36}$,解得x=3,故答案为:3;
(4)开始时容器中的压强与平衡时的压强之比等于反应前后的物质的量之和的比,为(6+6)mol:(1.2+2.4+0.6×3+1.2)mol/L×2L=10:11,
故答案为:10:11.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法计算、速率及压强比的计算方法为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
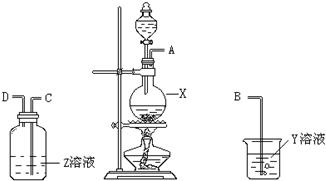 某化学课外兴趣小组为探究铜与浓硫酸反应产物的性质,拟用如图所示的装置进行实验.
某化学课外兴趣小组为探究铜与浓硫酸反应产物的性质,拟用如图所示的装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
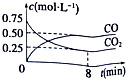 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.| 容器 | 甲 | 乙 |
| 反应物投入量 | 3mol Fe、 2mol CO2 | 4mol FeO、 3mol CO |
| CO的浓度(mol•L-1) | c1 | c2 |
| CO2的体积分数 | φ1 | φ2 |
| 体系压强(Pa) | p1 | p2 |
| 气态反应物的转化率 | α1 | α2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
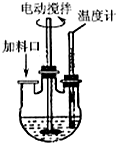 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时,其他条件不变,升高温度平衡正向移动 | |
| B. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 | |
| C. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 | |
| D. | 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com