
分析 由化学式可知n(KCl)=n(K+),n(CaCl2)=n(Ca2+),据此判断KCl与CaCl2的物质的量之比,令氯化钙的物质的量为xmol,则氯化钾为2xmol,根据氯离子列方程计算x的值,进而计算各自的物质的量,再根据m=nM计算质量,进而计算总质量.
解答 解:由化学式可知n(KCl)=n(K+),n(CaCl2)=n(Ca2+),故n(KCl):n(CaCl2)=n(K+):n(Ca2+)=2:1,令氯化钙的物质的量为xmol,则氯化钾为2xmol,根据氯离子可知,2x+2x=1,解得x=0.25,故m(KCl)=0.25mol×2×74.5mol/L=37.25g,m(CaCl2)=0.25mol×111g/mol/L=27.75g,氯化钙的物质的量是0.25mol,则KCl和CaCl2的质量之比:37.25:27.75=149:111;
含有1molCl-的该混合物,设氯化钙的物质的量是xmol,则KCl的物质的量是2xmol,根据Cl原子守恒得2x+2x=1,x=0.25,所以KCl的物质的量是0.5mol、氯化钙的物质的量是0.25mol,根据m=nM=74.5g/mol×0.5mol+111g/mol×0.25mol=65g,
故答案为:149:111;65.
点评 本题考查物质的量的有关计算,明确化学式中各元素原子个数之间的关系是解本题关键,熟练掌握基本公式,题目难度不大.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:选择题
| A. | 取代反应 | B. | 水解反应 | C. | 加聚反应 | D. | 缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后容器内的气体只有CO | |
| B. | 反应后生成的CO与反应前的CO2的物质的量之比为1:1 | |
| C. | 反应后生成的CO与反应前的CO2的分子数目之比为3:2 | |
| D. | 反应后容器内的气体与反应前的CO2所含的氧原子数目之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
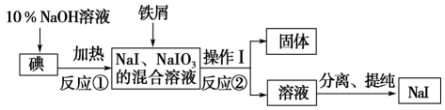
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所用NaOH已经潮解 | B. | 定容时俯视 | ||
| C. | 有少量NaOH溶液残留在烧杯里 | D. | 称量时误用“左码右物” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水煤气只能用作燃料 | |
| B. | 水煤气是一种二级能源,比煤直接燃烧污染小 | |
| C. | 等质量的CO和H2完全燃烧时,前者放热多 | |
| D. | 由③反应可以确定H2的燃烧热为241.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.
某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com