
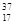 Cl、
Cl、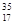 Cl为不同的核素,下列说法正确的是
Cl为不同的核素,下列说法正确的是
A.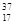 Cl2的摩尔质量是74
Cl2的摩尔质量是74
B.通常情况下,氯气做氧化剂,但氯气也具有还原性
C.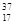 Cl、
Cl、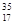 Cl互为同位素,
Cl互为同位素,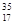 Cl2与
Cl2与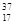 Cl2互为同素异形体
Cl2互为同素异形体
D.常温下,4.48L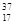 Cl2含有8NA个中子(NA为阿伏加德罗常数的值)
Cl2含有8NA个中子(NA为阿伏加德罗常数的值)
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| D | 738 | 1451 | 7733 | 10540 |
| E | 578 | 1817 | 2745 | 11578 |


查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)已知A、B、C、D、E、F均为周期表中前36号元素,且原子序数依次增大。A、B、C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等。A、F原子未成对电子是同周期中最多的,且F基态原子中电子占据三种不同形状的原子轨道。D和E原子的第一至第四电离能如下表所示:
| 电离能/ kJ·mol-1 | I1 | I2 | I3 | I4 |
| D | 738 | 1451 | 7733 | 10540 |
| E | 578 | 1817 | 2745 | 11578 |
⑴A、B、C三种元素的电负性最大的是 ▲ (填写元素符号),D、E两元素中D的第一电离能较大的原因是 ▲ 。
⑵F基态原子的核外电子排布式是 ▲ ;在一定条件下,F原子的核外电子从基态跃迁到激发态产生的光谱属于 ▲ 光谱(填“吸收”或“发射”)。
⑶根据等电子原理,写出AB+的电子式: ▲ 。
⑷已知:F3+可形成配位数为6的配合物。组成为FCl3·6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3∶2∶1。则绿色配合物的化学式为 ▲ 。
A.[CrCl(H2O)5]Cl2·H2O B.[CrCl2(H2O)4]Cl·2H2O
C.[Cr(H2O)6]Cl3 D.[CrCl3(H2O)3] ·3H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省等五校高三第二次联考理综化学试卷(解析版) 题型:填空题
铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
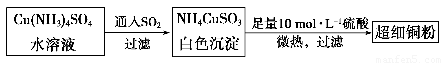
①NH4CuSO3中金属阳离子的核外电子排布式为______。N、O、S三种元素的第一电离能大小顺序为_______________________(填元素符号)。
②SO42-的空间构型为________。
(2)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因______________________;在该晶体中存在的化学键的种类有_____________。
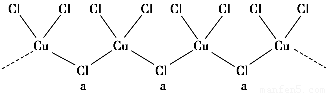
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为________。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为____________。
用晶体的X射线衍射法可以测得阿伏加德罗常数的值。对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜原子的直径约为__________pm,阿伏加德罗常数的值为________[已知Ar(Cu)=63.6]。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省八校高三下学期联考理综化学试卷(解析版) 题型:填空题
铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为???????????????????? 。N、O、S三种元素的第一电离能大小顺序为???????????????????????? (填元素符号)。
②Cu(NH3)4SO4中所含的化学键有????????????????????????
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。根据等电子体原理,CO分子的结构式为???????????? 。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为??????????? 。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为??????????? 。

(4)Cu2O的晶胞结构如图所示,该晶胞的边长为a cm,则Cu2O的密度为??????????? g·cm-3(用NA表示阿伏加德罗常数的数值)。

查看答案和解析>>
科目:高中化学 来源:09-10年如皋市高二下学期期末考试化学卷 题型:填空题
(12分)已知A、B、C、D、E、F均为周期表中前36号元素,且原子序数依次增大。A、B、C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等。A、F原子未成对电子是同周期中最多的,且F基态原子中电子占据三种不同形状的原子轨道。D和E原子的第一至第四电离能如下表所示:
|
电离能/ kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
D |
738 |
1451 |
7733 |
10540 |
|
E |
578 |
1817 |
2745 |
11578 |
⑴A、B、C三种元素的电负性最大的是 ▲ (填写元素符号),D、E两元素中D的第一电离能较大的原因是 ▲ 。
⑵F基态原子的核外电子排布式是 ▲ ;在一定条件下,F原子的核外电子从基态跃迁到激发态产生的光谱属于 ▲ 光谱(填“吸收”或“发射”)。
⑶根据等电子原理,写出AB+的电子式: ▲ 。
⑷已知:F3+可形成配位数为6的配合物。组成为FCl3·6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3∶2∶1。则绿色配合物的化学式为 ▲ 。
A.[CrCl (H2O)5]Cl2·H2O B.[CrCl2(H2O)4]Cl·2H2O
C.[Cr(H2O)6]Cl3 D.[CrCl3(H2O)3] ·3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com