
| A、100mL 1mol/L FeCl3溶液中含阳离子数为0.1NA |
| B、常温常压下1 mol NO2气体与水反应生成NA个NO3-离子 |
| C、0.6 g CaCO3与Mg3N2的混合物中所含质子数为0.3NA |
| D、80mL 10mol/L浓盐酸与足量MnO2反应,转移电子数为0.4NA |
| m |
| M |
| 2 |
| 3 |
| m |
| M |
| 0.6g |
| 100g/mol |


科目:高中化学 来源: 题型:
| A、用醋、石灰水验证蛋壳的主要成分是碳酸盐 |
| B、用碘酒验证淀粉是否完全水解 |
| C、用氮肥(硫酸铵)与鸡蛋白做蛋白质的变性实验 |
| D、用手电、纸盒、鸡蛋白等验证丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、1:2 | B、2:1 |
| C、1:1 | D、3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | ||||
| B、向10mL 1.5mol?L-1NaHSO4溶液中加入10mL 1mol?L-1Ba(OH)2溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O | ||||
| C、工业用石灰乳制漂白粉:Cl2+Ca(OH)2=Ca2++Cl-+ClO-+H2O | ||||
D、向20mL沸水中滴入1mL饱和FeCl3溶液,继续煮沸至溶液呈红褐色:Fe3++3H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上用石灰乳制取漂白粉:2OH-+Cl2=Cl-+ClO-+H2O |
| B、碳酸氢钠溶液中滴加酚酞呈粉红色:HCO3-+H2O=H2CO3+OH- |
| C、水玻璃可用于制备硅胶:SiO32-+2H+=H2SiO3(胶体) |
| D、标况下2.24LCl2通入100mL 1mol/L FeBr2溶液中:2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠溶液吸收过量的二氧化碳 OH-+CO2=HCO3- |
| B、亚硫酸氢铵溶液与足量氢氧化钠溶液反应 HSO3-+OH-=SO32-+H2O |
| C、氯气通入冷水中 Cl2+H2O=Cl-+ClO-+2H+ |
| D、碳酸镁悬浊液中加醋酸 CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
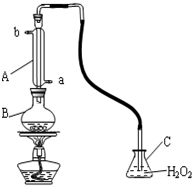 中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g?L-1.某兴趣小组用右图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.(可能用到的相对原子质量:H-1 O-16 S-32)
中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g?L-1.某兴趣小组用右图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.(可能用到的相对原子质量:H-1 O-16 S-32)查看答案和解析>>
科目:高中化学 来源: 题型:
| 电解 |
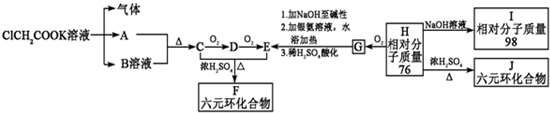
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com