
| ||
| A、1:2 | B、2:1 |
| C、1:1 | D、3:5 |
科目:高中化学 来源: 题型:
| 水① |
| ② |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、普通玻璃呈淡绿色是由于含Fe2+ |
| B、坩埚、蒸发皿都属于陶瓷制品 |
| C、唐“三彩”是一种玻璃制品 |
| D、高温下硅酸钙比碳酸钙稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高温、高压 |
| B、高温、低压 |
| C、低温、低压 |
| D、适当温度、高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、需要加热方能发生的反应一定是吸热反应 |
| B、放热的反应在常温下一定很易发生 |
| C、一个反应是放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定,而不是由反应是否需要加热而决定 |
| D、吸热反应发生过程中要不断从外界获得能量、放热反应发生过程中不再需要外界能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、砷元素的相对原子质量为74.92,由此可知砷原子核内有62个中子 |
| B、在AsCl3分子中,砷原子最外层满足8个电子稳定结构 |
| C、砷的氢化物化学式为AsH3,它是一种强氧化剂 |
| D、砷酸(H3AsO4)是强酸,其酸性与硫酸相仿 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 1mol/L FeCl3溶液中含阳离子数为0.1NA |
| B、常温常压下1 mol NO2气体与水反应生成NA个NO3-离子 |
| C、0.6 g CaCO3与Mg3N2的混合物中所含质子数为0.3NA |
| D、80mL 10mol/L浓盐酸与足量MnO2反应,转移电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
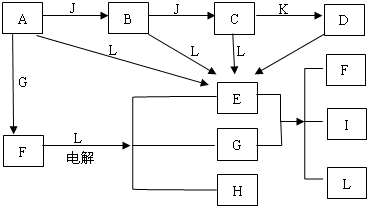
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com