
【题目】碳及其化合物广泛存在于自然界。随着科技的进步,利用化学反应原理将含碳物质进行合理转化,已成为资源利用、环境保护等社会关注问题的焦点。如CO2是人类工业生产排放的主要的温室气体,利用CO2制造更高价值化学品是目前的研究热点。
(1)①利用CH4和CO2这两种温室气体可以生产水煤气。已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =![]() 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H =+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H =![]() 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) 的△H =____kJ·mol-1
2CO(g)+2H2(g) 的△H =____kJ·mol-1
②250℃时,以镍合金为催化剂,向4 L恒容容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g) ![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
此温度下该反应的平衡常数K=_______。
(2)利用CO2催化加氢可以合成乙醇,反应原理为:2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g) H<0,设m为起始时的投料比,即m= n(H2)/ n(CO2)。
C2H5OH(g)+3H2O(g) H<0,设m为起始时的投料比,即m= n(H2)/ n(CO2)。
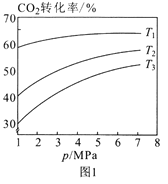
①图1中投料比相同,温度从高到低的顺序为____。
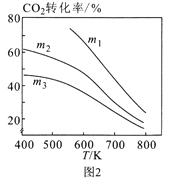
②图2中m1、m2、m3从大到小的顺序为____。
(3)高温电解技术能高效实现下列反应:CO2+H2O ![]() CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
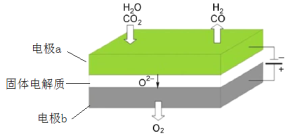
电极a的电极反应式____
(4)工业生产烟气中的CO2捕获技术之一是氨水溶液吸收技术,将烟气冷却至15.5℃~26.5℃后用氨水吸收过量的CO2。已知:NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。吸收后所得溶液的pH____7(填“>”、“=”或“<”)。
【答案】+247.3 64 ![]()
![]() CO2+H2O + 4e- =CO+H2+2O2 - >
CO2+H2O + 4e- =CO+H2+2O2 - >
【解析】
(1)①根据盖斯定律得出答案;②先按照三段式建立关系,再列关系,解得答案。
(2)①图1中投料比相同,同压下,从下往上,转化率变大,分析评估移动;②当温度相同,从下往上,转化率升高,分析反应物的量对转化率的影响得出答案。
(3)A极化合价降低,发生还原反应,从而写出答案。
(4)用氨水吸收过量的CO2生成碳酸氢铵,根据NH3·H2O的电离平衡常数与H2CO3的Ka1平衡常数分析得出答案。
(1)(1)根据盖斯定律,第1个反应减第2个反应的2倍,再减第3个反应的2倍,得到反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) 的△H =+247.3kJ·mol-1,故答案为:+247.3。
2CO(g)+2H2(g) 的△H =+247.3kJ·mol-1,故答案为:+247.3。
② CO2 (g) + CH4(g) ![]() 2CO(g) + 2H2(g)
2CO(g) + 2H2(g)
开始:6mol 6mol 0 0
转化:xmol xmol 2xmol 2xmol
平衡:(6-x)mol (6-x)mol 2xmol 2xmol
![]()
解得x = 4
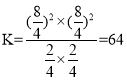 ,故答案为:64。
,故答案为:64。
(2)①图1中投料比相同,同压下,从下往上,转化率变大,平衡正向移动,减小温度,因此温度从高到低的顺序为T3 > T2 > T1,故答案为:T3 > T2 > T1。
②当温度相同,从下往上,转化率升高,则氢气量越来越大,即投料比m增大,因此图2中m1、m2、m3从大到小的顺序为m1 > m2 > m3,故答案为:m1 > m2 > m3。
(3)A极化合价降低,发生还原反应,因此电极a的电极反应式CO2+H2O +4e-= CO+H2+ 2O2-,故答案为:CO2+H2O +4e-= CO+H2+ 2O2-。
(4)用氨水吸收过量的CO2生成碳酸氢铵,由于NH3·H2O的Kb=1.7×10-5大于H2CO3的Ka1=4.3×10-7,因此吸收后所得溶液的pH > 7,故答案为:>。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向某容积为2L的恒容密闭容器中充入2molX(g)和1molY(g),发生反应2X(g)+Y(g)![]() 3Z(g)。反应过程中,持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g)。反应过程中,持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
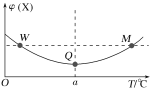
A.M点时,Y的转化率最大
B.平衡后充入X,达到新平衡时X的体积分数减小
C.升高温度,平衡常数减小
D.W、M两点Y的正反应速率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构、熔点/℃角度分析,原因是______________。
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因____________。
GeCl4 | GeBr4 | Gel4 | |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为__________,微粒之间存在的作用力是________。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C(
);C(![]() ,0,
,0,![]() ),则D原子的坐标参数为_________。
),则D原子的坐标参数为_________。
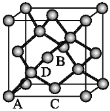
②晶胞参数:描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为_______ g·cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A.冰镇的啤酒打开后泛起泡沫
B.对N2+3H2![]() 2NH3的反应,使用铁触媒可加快合成氨反应的速率
2NH3的反应,使用铁触媒可加快合成氨反应的速率
C.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
D.工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度下,0.01mol/L的NaOH溶液和0.01mol/L的盐酸相比较,下列说法正确的是( )
A.两溶液的pH之和等于14
B.由水电离出的c(H+)都是1.0×10-12mol/L
C.由水电离出的c(OH-)相等
D.若将0.01mol/L的盐酸换成同浓度的醋酸,对水的电离的影响不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质在水溶液中的电离状况可以进行定量计算和推测。
(1)25℃时两种酸的电离平衡常数如表所示。
Ka1 | Ka2 | |
HA | 1×10-4 | |
H2B | 1×10-2 | 5×10-6 |
①25℃时,0.100mol·L-1的NaA溶液中H+、OH-、Na+、A-、HA的物质的量浓度由大到小的顺序是:___。pH=8的NaA溶液中由水电离出的c(OH-)=___mol·L-1。
②25℃时,0.100mol·L-1的NaHB溶液pH___7,理由是___。
③25℃时,向0.100mol·L-1的Na2B溶液中滴加足量0.100mol·L-1的HA溶液,反应的离子方程式为___。
(2)已知25℃时,向0.100mol·L-1的H3PO4溶液中滴加NaOH溶液,各含磷微粒的物质的量分数随pH变化的关系如图所示。
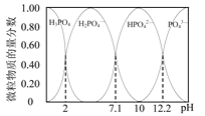
①当溶液pH由11到14时,所发生反应的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】75%的乙醇即医用酒精,因为杀灭病毒效果好且价格相对便宜,在生活中被大量使用。工业上主要用乙烯和水蒸气直接化合法制备乙醇。
回答下列问题:
(1)已知:
①2C2H6(g)+ O2(g)![]() 2C2H4(g)+ 2H2O(g) ΔH1=-192 kJ/mol
2C2H4(g)+ 2H2O(g) ΔH1=-192 kJ/mol
②2H2(g)+ O2(g)![]() 2H2O(g) ΔH2=-484 kJ/mol
2H2O(g) ΔH2=-484 kJ/mol
则③C2H6(g)![]() C2H4(g) + H2(g) ΔH3=__________kJ/mol
C2H4(g) + H2(g) ΔH3=__________kJ/mol
(2)某温度下,一定量的乙烷在刚性容器内发生反应③,起始浓度为 c0,平衡时容器内总压强增加了 20%,乙烷的转化率为_____,该温度下反应的平衡常数 K=__用含 c0 的式子表示)。
(3)气相直接水合法制取乙醇的反应④:H2O(g)+C2H4(g)![]() CH3CH2OH(g) ΔH4。恒压下,当起始 n(H2O)︰n(C2H4)=1︰1 时,催化反应相同时间,测得不同温度下 C2H4 转化为 CH3CH2OH 的转化率如下图所示。(图中虚线表示相同条件下C2H4的平衡转化率随温度的变化)
CH3CH2OH(g) ΔH4。恒压下,当起始 n(H2O)︰n(C2H4)=1︰1 时,催化反应相同时间,测得不同温度下 C2H4 转化为 CH3CH2OH 的转化率如下图所示。(图中虚线表示相同条件下C2H4的平衡转化率随温度的变化)

①分析图像可知ΔH4_____0(填“>”或“<”),理由是_______。
②X 点,v正_________v逆(填“>””“<”或“=”)。在 X 点的条件下,进一步提高 C2H4 转化率的方法是_______(写一种)。
(4)乙醇可用于制备各种燃料电池。下图是乙醇碱性燃料电池的结构示意图,使用的离子交换膜是_____(填“阳离子”或“阴离子”)交换膜,a 侧的电极反应式是_______。
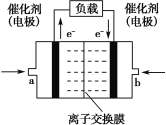
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2,5-二羟基苯甲酸甲酯俗称龙胆酸甲酯,可由龙胆酸与甲醇酯化得到,是合成制药中的常见中间体。其结构如右图所示。
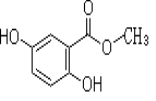
回答以下问题:
(1)龙胆酸甲酯所含官能团名称为 _________________
(2)龙胆酸甲酯的分子式为________________
(3)下列有关龙胆酸甲酯的描述,正确的是______________(填字母)。
a.能发生消去反应
b.能与氢气发生加成反应
c.能与浓溴水反应
(4)龙胆酸甲酯与足量氢氧化钠溶液反应的化学方程式___________________ 。
(5)写出满足下列条件的龙胆酸的两种同分异构体的结构简式_________、____________。
① 能发生银镜反应; ② 能使FeCl3溶液显色;
③ 酯类 ④苯环上的一氯代物只有两种
(6)已知X及其它几种有机物存在如下转化关系,且测得C4H8含有一个支链,A的核磁共振氢谱图中有两个吸收峰。
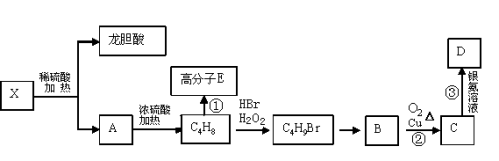
写出①的化学方程式____________________________________。
②的化学方程式______________________________________。
③化学方程式 ________________________________________。
写出X的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列油脂的性质和用途与其含有的碳碳双键(![]() )有关的是( )
)有关的是( )
A.适量摄入油脂,有助于人体吸收多种脂溶性维生素和胡萝卜素
B.利用油脂在碱性条件下的水解可以生产甘油和肥皂
C.植物油通过氢化可以制造植物奶油(人造奶油)
D.脂肪是人体中储存能量的重要物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com