
【题目】铅及其化合物广泛用于蓄电池、机械制造、电缆护防等行业。
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为_________;
(2)铅蓄电池是一种用途广泛的二次电池。铅蓄电池的电池反应通常表示如下:Pb+PbO2+2H2SO4 ![]() 2PbSO4 +2H2O。
2PbSO4 +2H2O。
铅蓄电池充电时,二氧化铅电极应与外接电源的_________________(填“正极”或“负极”)相连接,该电极的电极反应式为________________________________。
(3)利用电解法可制得金属铅。将PbO溶解在HCl和NaCl的混合溶液中,得到含[PbC14]2-的电解液。用惰性电极电解Na2PbCl4溶液制得金属Pb,装置如下图所示。
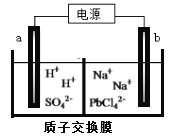
a电极的名称是__________,b电极的电极反应式为______________________
(4)PbO2可以通过石墨为电极电解Pb(NO3)2 和Cu(NO3)2的混合溶液制取。则阳极发生反应的电极反应式为______________,阴极上观察到的现象是____________。
【答案】 第六周期第ⅣA族 正极 PbSO4-2e-+2H2O=PbO2+4H++ SO42- 阳极 PbCl42-+2e-=Pb+4Cl- Pb2++2H2O-2e-=PbO2↓+ 4H+ 石墨上有红色铜析出
【解析】(1)C、Pb属于同一主族元素,Pb比C多4个电子层,则Pb含有6个电子层,则Pb位于第六周期第IVA族,故答案为:第六周期,第ⅣA族;
(2)铅蓄电池的电池反应为:Pb+PbO2+2H2SO4 ![]() 2PbSO4 +2H2O。放电时二氧化铅为正极,充电时,二氧化铅电极应与外接电源的正极相连接,充电时阳极的电极反应式为PbSO4-2e-+2H2O=PbO2+4H++ SO42-,故答案为:正极;PbSO4-2e-+2H2O=PbO2+4H++ SO42-;
2PbSO4 +2H2O。放电时二氧化铅为正极,充电时,二氧化铅电极应与外接电源的正极相连接,充电时阳极的电极反应式为PbSO4-2e-+2H2O=PbO2+4H++ SO42-,故答案为:正极;PbSO4-2e-+2H2O=PbO2+4H++ SO42-;
(3)将PbO溶解在HCl和NaCl的混合溶液中,得到含[PbC14]2-的电解液。用惰性电极电解Na2PbCl4溶液制得金属Pb。根据装置图,b电极上 [PbC14]2-发生还原反应得到金属Pb,b极为阴极,则a极为阳极,其中阴极的电极反应式为PbCl42-+2e-=Pb+4Cl-,故答案为:阳极;PbCl42-+2e-=Pb+4Cl-;
(4)阳极上Pb2+失去电子,得到PbO2,需要水参与反应,同时生成氢离子,电极反应式为:Pb2++2H2O-2e-=PbO2+4H+,阴极上,Cu2+获得电子生成Cu,附着在石墨电极上,即石墨上红色物质析出;故答案为:Pb2++2H2O-2e-=PbO2+4H+;石墨上红色物质析出。


科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是
A.医用酒精的浓度为 95%,此浓度杀灭新冠病毒效果最好
B.SO2排放会导致的环境污染是酸雨
C.牛大棒骨属于厨余垃圾(湿垃圾)
D.“水滴石穿、水乳交融”都不涉及化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W,X,Y,Z,M,N六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是( ) 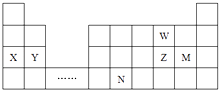
A.原子半径:Y>Z>W
B.单质的还原性:X>Y
C.溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D.元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国5G技术处于世界领先地位!生产5G芯片的关键材料有高纯硅、氮化镓、超高纯氢氟酸、线型酚醛树脂等。下列说法正确的是( )
A.石英砂用焦炭还原可直接制得高纯硅
B.氮化镓中氮、镓位于周期表中同主族
C.超高纯氢氟酸可用于清洗硅表面SiO2
D.线型酚醛树脂属于天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界卫生组织(WHO)将ClO2定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用.ClO2属于( )
A.酸
B.氧化物
C.碱
D.盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已建立化学平衡的可逆反应,当改变条件使化学反应向正反应方向移动时,下列有关叙述正确的是___________ (填序号)
①正反应速率一定大于逆反应速率
②反应物转化率一定增大
③生成物的产量一定增加
④反应物浓度一定降低
(2)下列溶液:①pH=1的盐酸,②0.05 molL-1的盐酸溶液 ③0.1molL-1的氯化钠溶液 由水电离的H+浓度由大到小顺序是___________(填序号)
(3)在25℃时,某稀溶液中由水电离产生的c(OH-)=10-10molL-1. 该溶液的pH可能为_________________
(4)有等体积等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是______________________
(5)一定温度下,可逆反应2NO2(g) ![]() 2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是_______(填序号)
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是_______(填序号)
①单位时间内生成n mol O2,同时生成2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com