
【题目】下列金属与水反应最剧烈的是
A. 锂 B. 钠 C. 钾 D. 铷
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是

A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.最高正化合价: O>N>CB.第一电离能: Na<Mg<Al
C.电负性: O>S>SeD.晶体类型相同: CO2 SiO2 GeO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务。
(1)汽车内燃机工作时发生反应:N2(g) + O2(g)![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向一体积固定的密闭容器中充入6.5mol N2和7.5mol O2,在5 min时反应达到平衡状态,测得此时容器中NO的物质的量为5mol。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向一体积固定的密闭容器中充入6.5mol N2和7.5mol O2,在5 min时反应达到平衡状态,测得此时容器中NO的物质的量为5mol。
①反应开始至达到平衡的过程中,容器中下列各项发生变化的是___(填序号)。
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
②假设容器体积为5L,则5min内该反应的平均速率υ(NO) =___;
(2)H2或CO可以催化还原NO以达到消除污染的目的。
①已知:N2(g) + O2(g) = 2NO(g) △H= +180.5 kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) △H=-571.6 kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是___;判断该反应自发进行的条件:___。
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应:2NO(g) + 2CO(g)![]() 2CO2(g) + N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。则该反应的△H___0(填“>”或“<”)。若催化剂的表面积S1>S2 ,在该图中画出c(NO)在T1、 S2条件下达到平衡过程中的变化曲线___。
2CO2(g) + N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。则该反应的△H___0(填“>”或“<”)。若催化剂的表面积S1>S2 ,在该图中画出c(NO)在T1、 S2条件下达到平衡过程中的变化曲线___。
(3)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图C为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图.若体系在T2、60MPa下达到平衡.

①能判断N2(g)+3H2(g)2NH3(g)达到平衡的是___(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②此时N2的平衡分压为__MPa.(分压=总压×物质的量分数)。计算出此时的平衡常数Kp=___(用平衡分压代替平衡浓度计算,结果保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物广泛用于蓄电池、机械制造、电缆护防等行业。
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为_________;
(2)铅蓄电池是一种用途广泛的二次电池。铅蓄电池的电池反应通常表示如下:Pb+PbO2+2H2SO4 ![]() 2PbSO4 +2H2O。
2PbSO4 +2H2O。
铅蓄电池充电时,二氧化铅电极应与外接电源的_________________(填“正极”或“负极”)相连接,该电极的电极反应式为________________________________。
(3)利用电解法可制得金属铅。将PbO溶解在HCl和NaCl的混合溶液中,得到含[PbC14]2-的电解液。用惰性电极电解Na2PbCl4溶液制得金属Pb,装置如下图所示。
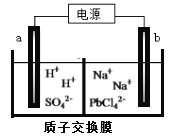
a电极的名称是__________,b电极的电极反应式为______________________
(4)PbO2可以通过石墨为电极电解Pb(NO3)2 和Cu(NO3)2的混合溶液制取。则阳极发生反应的电极反应式为______________,阴极上观察到的现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在V L Al2(SO4)3溶液中加入过量氨水,过滤得沉淀,然后在高温中灼烧沉淀最后得白色固体m g,则溶液中SO42-的物质的量浓度是
A. m/27V mol·L1 B. 2m/27V mol·L1
C. m/34V mol·L1 D. 3m/54V mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃与金属镁在无水乙醚中反应,可得格氏试剂R—MgX,它可与醛、酮等羰基化合物加成:![]() ,得产物经水解可以得到醇,这是某些复杂醇的合成方法之一,现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是
,得产物经水解可以得到醇,这是某些复杂醇的合成方法之一,现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是
A. 乙醛和氯乙烷 B. 甲醛和1-溴丙烷
C. 丙酮和一氯甲烷 D. 甲醛和2-溴丙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,将2 mol SO2和1mol O2充入10 L恒容密闭容器中,发生反应2SO2(g) +O2(g)![]() 2SO3(g) △H =-196 kJ mol-1。5 min时达到平衡,测得反应放热166. 6 kJ。下列说法错误的是
2SO3(g) △H =-196 kJ mol-1。5 min时达到平衡,测得反应放热166. 6 kJ。下列说法错误的是
A. 0~5 min内,用O2表示的平均反应速率V(O2)=0.017 mol·L-1·min-1
B. ![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
C. 若增大O2的浓度,SO2的转化率增大
D. 条件不变,若起始时充入4 mol SO2和2 mol O2,平衡时放出的热量小于333.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是合成聚碳酸酯的过程(PC)(反应条件和部分产物未写出):

信息提示:苯酚分子中与酚羟基直接相连的碳原子的邻、对位上的氢原子有很好的反应活性,易跟某些含羰基的化合物![]() (R、R′代表烷基或H原子)发生缩合反应生成新的有机物和水。苯酚还能发生如下反应生成有机酸酯:
(R、R′代表烷基或H原子)发生缩合反应生成新的有机物和水。苯酚还能发生如下反应生成有机酸酯:

请写出:
(1)X的结构简式____________。
(2)在一定条件下X与COClCl反应合成聚碳酸酯的化学方程式_________。
(3)X和浓溴水反应时,1 mol X最多能消耗Br2________mol。
(4)与乙酸苯酚酯分子式相同,分子中含有苯环且属于酯的其他可能有机物的结构简式_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com