
【题目】常温下,浓度均为0.1 mol·Lˉ1的NaOH溶液和氨水,下列说法正确的是
A. c(NH3H2O) + c(![]() ) = c(Na+)
) = c(Na+)
B. NH3·H2O的电离方程式:NH3H2O ===![]() + OH-
+ OH-
C. 氨水的pH大于NaOH溶液
D. 将浓度为0.1 mol·Lˉ1的盐酸和氨水等体积混合后,所得溶液中:c(OH-) > c(H+)
科目:高中化学 来源: 题型:
【题目】下列有关金属腐蚀与防护的说法正确的是( )

A. 图1中,插入海水中的铁棒,越靠近底端,腐蚀越严重
B. 镀层破损后,镀锌铁比镀锡铁更耐用
C. 纯银器表面在空气中因电化学腐蚀渐渐变暗
D. 图2中,金属棒X若为Cu,可使埋在地下的钢管免受腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学欲制取纯净的Fe(OH)2 ,根据如图所示的装置进行试验。A管中是Fe+H2SO4 , B管中是NaOH溶液,请回答下列问题。
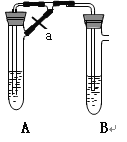
(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是 。
(2)同学乙:打开a,使A管中反应一段时间再 夹紧止水夹a,实验中在B管中观察到的现象是 ,B中发生反应的离子方程式为
(3)同学乙打开a的目的 ; (填甲或乙)同学可成功。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。

(1)硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?请将选项字母填在下列各小题的横线上: A强酸性 B 吸水性 C 脱水性 D 强氧化性
①浓硫酸使木条变黑__________
②热的浓硫酸与铜片反应__________
(2)现用该浓硫酸配制100mL 1mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④ 药匙;⑤量筒;⑥托盘天平。请回答下列问题:
配制稀硫酸时,上述仪器中不需要使用的有__________(选填序号),还缺少的仪器有__________(写仪器名称);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 标准状况下,11.2L14CO2含有的中子数为11NA
B. 5.6gFe粉与足量S粉加热充分反应转移的电子数为0.2NA,
C. 1molNa2O2固体中所含离子数目为4NA
D. 1LpH=6的纯水中含有OHˉ的数目为10-8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pC(H2A)、pC(HAˉ)、pC(A2-)随着溶液pH的变化曲线如图所示。下列说法一定正确的是

A. pH=4时,c(HAˉ)<c(A2-)
B. c(H2A)+c(HAˉ)+c(A2-)是定值
C. 该酸的电离常数Ka1=10-1.3
D. 常温下,NaHA的水溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧、氯、钠、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态氯原子的价电子排布图是________________________;基态铜原子核外电子占有的空间运动状态有____________种
(2)碳、氮、氧三种元素中第一电离能最大的是____________ (填元素符号)CO32-中碳原子的杂化轨道类型为____________。
(3)相同条件下,水的沸点高于液氨,原因是________________________。
(4)铜与CNˉ可形成络合离子[Cu(CNˉ)4]2-,写出一种与CNˉ互为等电子体的分子的化学式____________;1 mol[ Cu(CNˉ)4]2-中含有____________molσ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为_________。
(5)氯化钠的晶胞如图所示。晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中。一个氯离子周围离氯离子最近的氯离子数目为__________个。已知:半径r(Clˉ)=apm,r(Na+)=bpm。摩尔质量M(NaCI)=cg·mol-1则氯化钠晶体的密度为_________g·cm-3

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O) (相对分子质量为990)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。

已知:(1)Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;(2)铅与冷盐酸、冷硫酸几乎不起作用。
请回答下列问题:
(1)写出步骤①“转化”的化学方程式______________________________________。
(2)步骤③“酸溶”,最适合选用的酸为______________,为提高酸溶速率,可采取的措施是__________(任意写出一条)。
(3)若步骤④沉铅”后的滤液中c(Pb2+)=1.82×10-5mol/L,则此时c(SO42-)=______mol/L。
(4)从原子利用率的角度分析该流程的优点为_______________________。
(5)步骤⑥“合成”三盐的化学方程式为____________________________。若得到纯净干燥的三盐49.5t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为__ % (结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用硫酸银与硫黄培烧制备氧化铝,再电解氧化铝,发生反应如下:反应Ⅰ:2A12(SO4)3+3S![]() 2Al2O3+9SO2↑
2Al2O3+9SO2↑
反应Ⅱ:2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
下列说法正确的是
A. 反应Ⅰ中S 单质是氧化剂
B. 反应Ⅱ中铝元素被氧化
C. 当生成5.4gAl时,反应Ⅰ和Ⅱ共转移1.2mole-
D. 反应Ⅰ中氧化产物与还原产物物质的量之比为2:9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com