
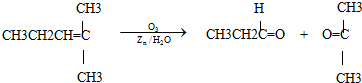
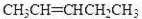
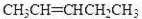
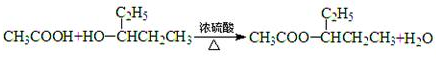

| 12n |
| 12n+n+6 |
| 12n |
| 12n+n+6 |
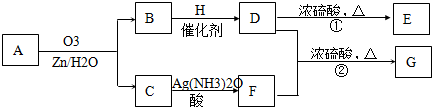
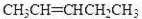 ,也可以和羧酸F发生酯化反应,生成酯G,酯G有8个C原子,醇D中有5个C原子,所以羧酸F中有3个C原子,F是丙酸,结构式为CH3CH2COOH,醇D消去只能得到一种烯烃,D为3-戊醇,结构为(C2H5)2CHOH,
,也可以和羧酸F发生酯化反应,生成酯G,酯G有8个C原子,醇D中有5个C原子,所以羧酸F中有3个C原子,F是丙酸,结构式为CH3CH2COOH,醇D消去只能得到一种烯烃,D为3-戊醇,结构为(C2H5)2CHOH,| 12n |
| 12n+n+6 |
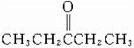 )和C(CH3CH2CHO),可知A的结构为(CH3CH2)2C=CHCH2CH3,通过以上分析知,E的结构简式为:
)和C(CH3CH2CHO),可知A的结构为(CH3CH2)2C=CHCH2CH3,通过以上分析知,E的结构简式为: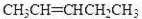 ,
,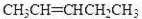 ;
; ,
, ;
;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com