
【题目】某学生的实验报告所列出的下列数据中合理的是( )
A.用10mL量筒量取7.13mL稀盐酸
B.用pH计测得某稀盐酸的pH为1.54
C.用广泛pH试纸测得某溶液的pH为2.3
D.配制100mL1mol/L的NaCl溶液用托盘天平称取5.85gNaCl固体
科目:高中化学 来源: 题型:
【题目】下列各图均能表示甲烷的分子结构,按要求回答下列问题。
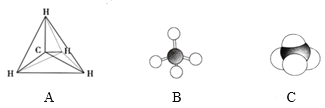
(1)甲烷的比例模型是______(填序号)。
(2)相对分子质量为100的烷烃的分子式是_____。
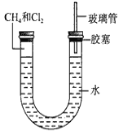
(3)甲烷与氯气的体积比为1:1,光照条件下在如图所示的装置中反应,则得到的产物为_____。
A.CH3Cl、HCl B.CCl4、HCl
C.CH3Cl、CH2Cl2 D.CH3Cl、CH2Cl2、CHCl3、CCl4、HCl
(4)甲烷最简单的同系物与氯气光照条件下反应,其生成物的化学式最多可能有_____种。
A.5 B.9 C.10 D.7
(5)经过几个小时的反应后,U形管右端的水柱变化是______。
A.升高 B.降低 C.不变 D.无法确定
(6)工业酒精含有甲醇,其结构简式为:CH3OH,可由甲烷经过一系列变化得到,写出甲醇与O2在铜作催化剂加热条件下的反应_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C. 向盐酸中加入氨水至中性,溶液中![]()
D. NH4HSO4和NaOH混合呈中性C(Na+)>C(SO42—)>C(NH4+)>C(NH3·H2O)>C(H+)=C(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某原子 X 的原子序数为 26,则下列叙述不正确的是( )
A.X 是金属元素B.X 外围电子排布式是 3d64s2
C.X 是 d 区元素D.X 在周期表中位于第四周期,第Ⅷ B 族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于容量瓶的使用,下列操作正确的是
A. 使用前要检验容量瓶是否漏液
B. 用蒸馏水荡洗后必须要将容量瓶烘干
C. 为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行
D. 为了使所配溶液浓度均匀,定容结束后,手握瓶颈,左右振
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2可用作有机合成的催化剂,某校同学设计实验用干燥的HBr与Fe反应制备少量FeBr2,实验装置如下(部分夹持装置已省略):
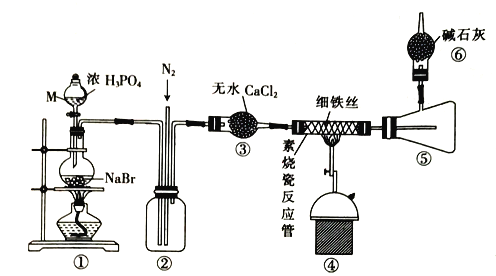
已知:高温时FeBr3会分解为FeBr2,FeBr2易吸水潮解,800℃以上可升华。
回答下列问题:
(1)仪器M的名称是____________;装置①中生成HBr的化学方程式为___________。
(2)反应开始前通入N2的目的是____________,反应过程中通入N2的目的是____________。
(3)进入装置④的气体中混有少量Br2对产品纯度_______(填“有”或“没有”)影响,理由是___________。
(4)装置⑥的作用是___________,逸出的气体主要是___________(填化学式)。
(5)设计实验方案探究得到的FeBr2中Fe2+和Brˉ的还原性强弱:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个体积相同的容器,一个盛有NO,另一个盛有N2和O2,在同温同压下两容器内的气体一定具有相同的( )
①原子总数;②质子总数;③分子总数;④质量。
A. ④ B. ① C. ②④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是( )
A. 肯定有SO2和NO
B. 肯定没有Cl2、O2和NO2
C. 可能有Cl2和O2
D. 肯定只有NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂。回答下列问题:
(1)NOCl虽然不稳定,但其原子均达到8e-稳定结构,NOCl的电子式为_________________。
(2)一定条件下,在密闭容器中发生反应:2NOCl(g)![]() 2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
序号 | c(NOCl)/(mol·L-1) | v正/(mol·L-1·s-1) |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
则n=_________;k=___________。
(3)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
序号 | 热化学方程式 | 平衡常数 |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=______kJ/mol;K3=______(用K1和K2表示)。
(4)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图曲线a所示,则ΔH3=______(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强(p)随时间(t)
的变化如图曲线b所示,则改变的条件是_____________;K3=___________L/mol;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com