
【题目】某化学小组用如图所示装置制取氯气,下列说法不正确的是( )
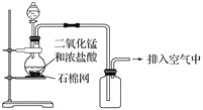
A.该装置图中至少存在两处明显错误
B.该实验中收集氯气的方法不正确
C.为了防止氯气污染空气,必须进行尾气处理
D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NH3可用于生产硝酸和尿素。
(1)生产硝酸:
①NH3催化氧化是工业制硝酸的第一步反应,其化学方程式是______________。
②除此之外,相同条件下还可能发生以下副反应:
4NH3(g)+4O2(g)=2N2O(g)+6H2O(g) ![]()
4NH3(g)+3O2(g)=2N2O(g)+6H2O(g) ![]()
两个副反应在理论上趋势均很大,但实际生产中影响并不大,原因是______________。
(2)生产尿素:
①尿素的合成分两步进行;
a.2NH3(g)+CO2(g)![]() NH2COONH4(l)
NH2COONH4(l) ![]()
b.NH2COONH4(l)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l) ![]()
则总反应2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)的
CO(NH2)2(l)+H2O(l)的![]() =_____________。
=_____________。
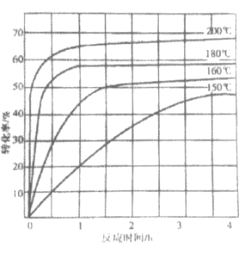
②下图为n(NH3):n(CO2)=4:1时,温度对CO2的转化率的影响。解释温度升高CO2的平衡转化率增大的原因:______________。
③测定尿素样品含氮量的方法如下:取a g尿素样品,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则尿素样品中氮元素的质量分数是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种性能非常优越的金属,以钛铁矿(主要成分是FeTiO3,还含有少量Fe2O3)为原料制备钛的流程如下:
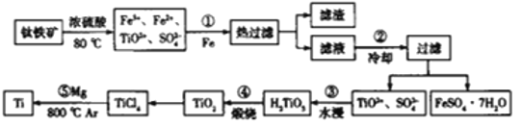
(1)FeTiO3中Ti的化合价为_______________________.
(2)步骤①中加Fe的目的是_____________________(用离子方程式表示).
(3)步骤②冷却的目的是______________________________________________.
(4)水浸过程发生的反应为TiO2++2H2O=H2TiO3↓+2H+,从成本或废物的再利用因素考虑,水浸后废液中应加入____________________处理.
(5)写出步骤⑤的化学方程式:____________________________,该反应在Ar气氛中进行的目的是________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a.  b.
b.  c.
c.  d.
d. 
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知下列物质的K:CaCO35×10-9;BaSO41×10-10:BaCO35×10-8:Mg(OH)25.6×10-12;Ca(OH)21.4×10-5,氯碱工业中,电解所用的饱和食盐水需精制,去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+),精制流程如下(注:溶液A为NaOH溶液)
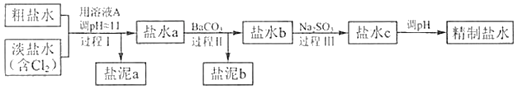
①盐泥a除泥沙外,还含有的物质是___。
②过程Ⅰ中将NH4+转化为N2的离子方程式是___。
⑨过程Ⅱ中除去的离子有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是立体的网状结构,其结构如图所示。
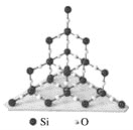
下列关于二氧化硅晶体的说法不正确的是( )
A. 晶体中每个硅原子与4个氧原子相连
B. 晶体中硅、氧原子个数比为1∶2
C. 晶体中最小环上的原子数为8
D. 晶体中共用一个硅原子的最小的环的原子数目为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 为地壳中含量最高的过渡金属元素,
为地壳中含量最高的过渡金属元素,![]() 与
与![]() 同主族,
同主族,![]() 与
与![]() 同周期,且
同周期,且![]() 与
与![]() 的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
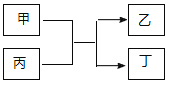
A.![]() 、
、![]() 形成的一种化合物具有漂白性
形成的一种化合物具有漂白性
B.![]() 、
、![]() 形成的离子化合物可能含有非极性键
形成的离子化合物可能含有非极性键
C.![]() 的单质能与丙反应置换出
的单质能与丙反应置换出![]() 的单质
的单质
D.丁为黑色固体,且1mol甲与足量丙反应转移电子3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质是含钠元素的单质或化合物,其中B为淡黄色固体,它们有如图所示的转化关系:
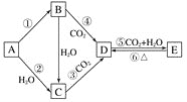
(1)推断各符号所代表的物质的化学式:A__,B__,C__,D__,E__。
(2)写出反应②的化学方程式:___。
(3)向D的饱和溶液中通入CO2时,反应的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A.50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA
B.2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0.2NA之间
C.用惰性电极电解饱和食盐水,若线路中通过NA 个电子,则阴极产生11.2L (标况)气体
D.已知N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92kJ·mol-1,现有0.1molN2与0.3molH2混合反应,可放热9.2kJ
2NH3(g) ΔH=-92kJ·mol-1,现有0.1molN2与0.3molH2混合反应,可放热9.2kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com