
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0,
CO2(g)+H2(g) △H<0,
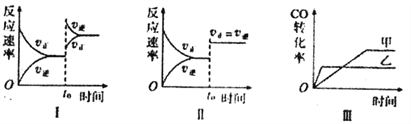
下列分析中正确的是
A. 图I研究的是t0时增大反应物浓度对反应速率的影响
B. 图II中t0时改变的条件只能是增大压强
C. 图III研究的是催化剂对化学平衡的影响,且乙使用了催化剂
D. 图III研究的是温度对化学平衡的影响,且乙的温度较高
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】据某权威刊物报道,科学家在宇宙中发现了H3分子,对于相同物质的量的H3和H2,下列各项中一定相等的是
A.原子数 B.分子数 C.体积 D. 质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
(1)①将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈;与盐酸反应产生的气体最多.
②向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S 强,反应的离子方程式为 .
(2)利用如图装置可验证同主族元素非金属性的变化规律 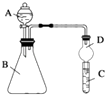
③仪器B的名称为 , 干燥管D的作用为 .
④若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C的现象,即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气.
⑤若要证明非金属性:N>C>Si,则在A中加、B中加碳酸钙、C中加溶液观察到C中溶液的现象,即可证明.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。

下列说法正确的是
A. 卤素单质(X2)与水反应均可生成两种酸
B. 用电子式表示MgF2的形成过程为: ![]()
C. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
D. 由图可知此温度下MgI2(s)与Cl2(g)反应的热化学方程式为:MgI2(s)+Cl2(g)=MgCl2(s)+I2(g),ΔH=-277kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关使用托盘天平的叙述,不正确的是
A. 称量前先调节托盘天平的零点
B. 称量时左盘放被称量物,右盘放砝码
C. 潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量
D. 用托盘天平可以准确称量至0.1 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探索外界条件对反应:aX(g)+bY(g)![]() cZ(g)的影响,将X和Y以物质的量之比为a :b 开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如右图所示。下列判断正确的是
cZ(g)的影响,将X和Y以物质的量之比为a :b 开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如右图所示。下列判断正确的是

A. △H>0, a+b>c △S>0 B. △H>0, a+b<c △S<0
C. △H<0, a+b>c △S<0 D. △H<0, a+b<c △S>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对工业污泥中的Cr元素回收与再利用的工艺如下(己知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | — | 一 | — |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9 (>9溶解) |
(1)实验室用98% (密度为1.84 g·cm-3)的浓硫酸配制200mL4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________mL (保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需_____________________。
(2)在上述配制稀硫酸过程中,会导致所配溶液浓度偏大的操作是___________(填序号)
a. 转移溶液时,没有等溶液冷却至室温 b.量取浓硫酸时,俯视刻度线
c.当容量瓶中液体占容积2/3左右时,未振荡摇匀 d. 定容时俯视刻度线
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr (CrO42- 或Cr2O72-),以便于与杂质离子分离;另一方面是_____________________________。(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是___________________。
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn +nNa+,被交换的杂质离子是________________。
(6)通SO2气体时,其化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组各有两对物质,它们都能用分液漏斗分离的是
A. 四氯化碳和水,酒精和水 B. 汽油和水,苯和水
C. 甘油和水,乙醇和水 D. 醋酸和水,植物油和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
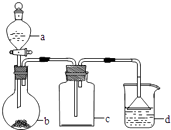
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com