
【题目】某工厂对工业污泥中的Cr元素回收与再利用的工艺如下(己知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | — | 一 | — |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9 (>9溶解) |
(1)实验室用98% (密度为1.84 g·cm-3)的浓硫酸配制200mL4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________mL (保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需_____________________。
(2)在上述配制稀硫酸过程中,会导致所配溶液浓度偏大的操作是___________(填序号)
a. 转移溶液时,没有等溶液冷却至室温 b.量取浓硫酸时,俯视刻度线
c.当容量瓶中液体占容积2/3左右时,未振荡摇匀 d. 定容时俯视刻度线
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr (CrO42- 或Cr2O72-),以便于与杂质离子分离;另一方面是_____________________________。(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是___________________。
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn +nNa+,被交换的杂质离子是________________。
(6)通SO2气体时,其化学方程式为_______________________。
【答案】 65.2 250mL容量瓶 a c d 2Fe2++H2O2+2H+ = 2Fe3++2H2O Fe3+、Al3+ Ca2+、Mg2+ Na2Cr2O7+3SO2+11H2O = 2CrOH(H2O)5SO4↓+Na2SO4
【解析】(1)98% (密度为1.84 g·cm-3)的浓硫酸的物质的量浓度为![]() mol/L=18.4mol/L,实验室用98% (密度为1.84 g·cm-3)的浓硫酸,配制200mL4.8 mol·L-1的硫酸溶液,应选用250mL容量瓶配制250mL溶液,所以配制时需要量取98%的浓硫酸的体积为
mol/L=18.4mol/L,实验室用98% (密度为1.84 g·cm-3)的浓硫酸,配制200mL4.8 mol·L-1的硫酸溶液,应选用250mL容量瓶配制250mL溶液,所以配制时需要量取98%的浓硫酸的体积为![]() =65.2mL。所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需250mL容量瓶。
=65.2mL。所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需250mL容量瓶。
(2)在上述配制稀硫酸过程中,a. 转移溶液时,没有等溶液冷却至室温,定容后待冷却到室温,溶液体积会偏小,所配溶液浓度偏大;,b.量取浓硫酸时,俯视刻度线,量取浓硫酸体积偏小,所配溶液浓度偏小;c.当容量瓶中液体占容积2/3左右时,未振荡摇匀,由于水的密度小于硫酸的密度,则定容、摇匀后溶液体积偏小,浓度偏大;d. 定容时俯视刻度线,所配溶液体积偏小,浓度偏大。综上所述,会导致所配溶液浓度偏大的操作是a c d 。
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr (CrO42- 或Cr2O72-),以便于与杂质离子分离;另一方面是把亚铁离子氧化为铁离子以方便除杂,离子方程式为2Fe2++H2O2+2H+ = 2Fe3++2H2O。
(4)由表中数据可知,调节溶液的pH=8除去的杂质离子是Fe3+、Al3+。
(5)Fe3+、Al3+除尽后 ,还有Ca2+、Mg2+未除去,所以被交换的杂质离子是Ca2+、Mg2+。
(6)前面加入H2O2把+3价Cr氧化成+6价Cr (CrO42- 或Cr2O72-),根据产品CrOH(H2O)5SO4中铬的化合价可知,通SO2气体是为了把+6价Cr还原为+3价,所以其化学方程式为Na2Cr2O7+3SO2+11H2O = 2CrOH(H2O)5SO4↓+Na2SO4。


科目:高中化学 来源: 题型:
【题目】正确掌握化学用语是学好化学的基础,下列有关表述正确的是( )
A.H,D,T互为同素异形体
B.氨分子中的化学键为非极性共价键
C.NH4Cl的电子式: ![]()
D.S2﹣的结构示意图: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中正确的有
①沉淀中氢氧根的质量为(n-m)g
②恰好溶解后溶液中的NO3-的物质的量为![]() mol
mol
③反应过程中转移的电子的物质的量为![]() mol
mol
④生成NO气体的体积在标准状况下为![]() L
L
⑤与合金反应的硝酸的物质的量为![]() mol
mol
A. 5项 B. 4项 C. 3项 D. 2项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0,
CO2(g)+H2(g) △H<0,
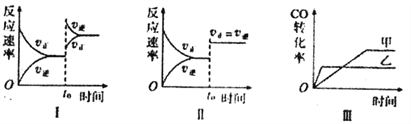
下列分析中正确的是
A. 图I研究的是t0时增大反应物浓度对反应速率的影响
B. 图II中t0时改变的条件只能是增大压强
C. 图III研究的是催化剂对化学平衡的影响,且乙使用了催化剂
D. 图III研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲称取5.5 g食盐晶体。但在操作时将食盐晶体与砝码的位置放颠倒了,则实际称得的食盐晶体的质量为(1 g 以下用游码)
A. 6.5 g B. 6.0 g C. 5.5 g D. 4.5 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是( ) 
A.若A为浓盐酸,B为MnO2 , C中盛品红溶液,则C中溶液不褪色
B.若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色
D.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性I﹣>Fe2+>I2,在水溶液中I2可被Cl2氧化为IO3﹣,向含溶质amol的FeI2溶液中通入bmol Cl2,充分反应(不考虑单质与水的反应).
(1)当a=2b时,反应后的粒子浓度之比:c(Fe2+):c(I﹣):c(Cl﹣)=________。
(2)若反应后溶液中I2与IO3﹣的物质的量为1:1,则反应中转移的电子_______mol(用含a的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com