
【题目】现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中正确的有
①沉淀中氢氧根的质量为(n-m)g
②恰好溶解后溶液中的NO3-的物质的量为![]() mol
mol
③反应过程中转移的电子的物质的量为![]() mol
mol
④生成NO气体的体积在标准状况下为![]() L
L
⑤与合金反应的硝酸的物质的量为![]() mol
mol
A. 5项 B. 4项 C. 3项 D. 2项
【答案】A
【解析】试题分析:m克铝镁合金转化为氢氧化镁和氢氧化铝时质量变为n克,增加的是氢氧根的质量。所以①沉淀中氢氧根的质量为(n-m)g,①正确;反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n克,此时溶液中的溶质为硝酸钠,由钠离子守恒可知,n(NO3-)= n(NaNO3)=n(NaOH)= ![]() mol,所以②正确;由Mg ~ 2e - ~ Mg(NO3)2~ Mg(OH)2、Al ~ 3e - ~ Al(NO3)3~ Al(OH)3可知,n(e -)=n(OH-)=
mol,所以②正确;由Mg ~ 2e - ~ Mg(NO3)2~ Mg(OH)2、Al ~ 3e - ~ Al(NO3)3~ Al(OH)3可知,n(e -)=n(OH-)=![]() mol,所以③正确;由电子转移守恒可知,n(NO)=
mol,所以③正确;由电子转移守恒可知,n(NO)= ![]() mol,所以生成NO气体的体积在标准状况下为
mol,所以生成NO气体的体积在标准状况下为![]() L,④正确;因为m克铝镁合金与稀硝酸恰好完全溶解,参加反应的硝酸中,被还原的部分生成NO。未被还原的生成硝酸镁和硝酸铝,这部分硝酸根在前面已经求出,所以与合金反应的硝酸的物质的量为n(NO)+ n(NO3-)=
L,④正确;因为m克铝镁合金与稀硝酸恰好完全溶解,参加反应的硝酸中,被还原的部分生成NO。未被还原的生成硝酸镁和硝酸铝,这部分硝酸根在前面已经求出,所以与合金反应的硝酸的物质的量为n(NO)+ n(NO3-)=![]() mol,⑤正确。综上所述,A正确,本题选A。
mol,⑤正确。综上所述,A正确,本题选A。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为主要成份是Al2O3 , 还含有SiO2和Fe2O3)提取氧化铝并冶炼Al的操作过程如下: 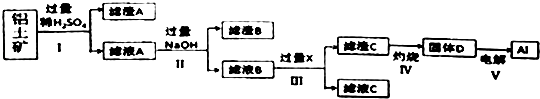
(1)滤渣A是 , 滤渣B是 .
(2)过程 I、II、III的分离操作的名称是 .
(3)过程 IV中灼烧时盛放药品的仪器名称是 , 发生反应的化学方程式是 .
(4)过程 III中发生反应生成滤渣C的离子方程式表示为 .
(5)取滤液B100mL,加入1molL﹣1盐酸200mL时,沉淀量达到最大且质量为11.7g.则溶液B中c(AlO2﹣)= , c(Na+)>molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
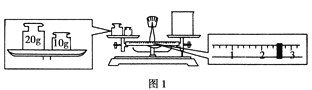
【题目】(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图1所示。由图中可以看出,该同学在操作时的一个错误是___________________,烧杯的实际质量为__________ g。
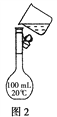
(2)需配制150 mL 0.2 mol·L-1 NaCl溶液,该同学转移溶液的示意图如图2所示。指出实验中存在的两个错误:_________________________________。
(3)用质量分数为98%密度为1.84 g·cm-3的浓硫酸配制1 000 mL 0.1 mol·L-1的稀硫酸。
①应用量筒量取浓硫酸________ mL;
②配制硫酸时需用到的仪器有量筒、小烧杯、玻璃棒、_______________________;
③下列操作使所配制溶液的物质的量浓度偏高的是________(填序号)。
A.称量时用了生锈的砝码 B.将NaOH放在纸张上称量
C.定容时俯视刻度线 D.往容量瓶中转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯 F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
(1)①将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈;与盐酸反应产生的气体最多.
②向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S 强,反应的离子方程式为 .
(2)利用如图装置可验证同主族元素非金属性的变化规律 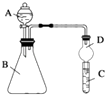
③仪器B的名称为 , 干燥管D的作用为 .
④若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C的现象,即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气.
⑤若要证明非金属性:N>C>Si,则在A中加、B中加碳酸钙、C中加溶液观察到C中溶液的现象,即可证明.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《太平惠民和剂局方》中对精制蜡过程有如下记载:.....先将蜡六两熔化作汁,以重绵滤去滓,以好酒一升,于银石器内煮蜡熔,数沸倾出,候酒冷,其蜡自浮,取蜡称用。”文中涉及的操作方法是( )
A. 蒸馏 B. 升华 C. 干馏 D. 蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。

下列说法正确的是
A. 卤素单质(X2)与水反应均可生成两种酸
B. 用电子式表示MgF2的形成过程为: ![]()
C. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
D. 由图可知此温度下MgI2(s)与Cl2(g)反应的热化学方程式为:MgI2(s)+Cl2(g)=MgCl2(s)+I2(g),ΔH=-277kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关使用托盘天平的叙述,不正确的是
A. 称量前先调节托盘天平的零点
B. 称量时左盘放被称量物,右盘放砝码
C. 潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量
D. 用托盘天平可以准确称量至0.1 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对工业污泥中的Cr元素回收与再利用的工艺如下(己知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | — | 一 | — |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9 (>9溶解) |
(1)实验室用98% (密度为1.84 g·cm-3)的浓硫酸配制200mL4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________mL (保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需_____________________。
(2)在上述配制稀硫酸过程中,会导致所配溶液浓度偏大的操作是___________(填序号)
a. 转移溶液时,没有等溶液冷却至室温 b.量取浓硫酸时,俯视刻度线
c.当容量瓶中液体占容积2/3左右时,未振荡摇匀 d. 定容时俯视刻度线
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr (CrO42- 或Cr2O72-),以便于与杂质离子分离;另一方面是_____________________________。(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是___________________。
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn +nNa+,被交换的杂质离子是________________。
(6)通SO2气体时,其化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对甲烷、乙烯性质的描述中,不正确的是( )
A.乙烯能使溴水褪色
B.在一定条件下,乙烯自身加聚生成聚乙烯
C.甲烷能使酸性高锰酸钾溶液褪色
D.在光照条件下,甲烷与氯气发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com