
【题目】工业上用铝土矿(主要成分为主要成份是Al2O3 , 还含有SiO2和Fe2O3)提取氧化铝并冶炼Al的操作过程如下: 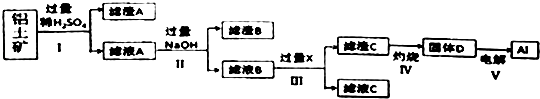
(1)滤渣A是 , 滤渣B是 .
(2)过程 I、II、III的分离操作的名称是 .
(3)过程 IV中灼烧时盛放药品的仪器名称是 , 发生反应的化学方程式是 .
(4)过程 III中发生反应生成滤渣C的离子方程式表示为 .
(5)取滤液B100mL,加入1molL﹣1盐酸200mL时,沉淀量达到最大且质量为11.7g.则溶液B中c(AlO2﹣)= , c(Na+)>molL﹣1 .
【答案】
(1)SiO2(或二氧化硅);Fe(OH)3(或氢氧化铁)
(2)过滤
(3)坩埚;2Al(OH)3 ![]() Al2O3+3H2O
Al2O3+3H2O
(4)AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3﹣
(5)1.5mol?L﹣1;6.5
【解析】解:铝土矿中加入稀硫酸,沉淀A为SiO2 , 滤液A中含有硫酸铝、硫酸铁,加入过量NaOH,沉淀B为Fe(OH)3 , 滤液B中含有NaAlO2 , 通入二氧化碳气体,滤液C中含有碳酸钠或碳酸氢钠,滤渣C为Al(OH)3 , Al(OH)3在加热分解可生成D为Al2O3 , 电解Al2O3生成铝,
(1.)SiO2和稀硫酸不反应,则滤渣A是SiO2(或二氧化硅),滤液A中含有硫酸铝、硫酸铁,加入过量NaOH,沉淀B为Fe(OH)3 ,
所以答案是:SiO2(或二氧化硅);Fe(OH)3(或氢氧化铁);
(2.)过程 I、II、III分离溶液和沉淀,应为过滤操作,所以答案是:过滤;
(3.)过程 IV用于灼烧固体氢氧化铝,应在坩埚中进行,发生反应为2Al(OH)3 ![]() Al2O3+3H2O,
Al2O3+3H2O,
所以答案是:坩埚;2Al(OH)3 ![]() Al2O3+3H2O;
Al2O3+3H2O;
(4.)滤液B的成分是偏铝酸钠,向其中通入过量的二氧化碳,反应为:AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3﹣ , 所以答案是:AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3﹣;
(5.)根据以上分析滤液B中含有硫酸钠、偏铝酸钠、过量的氢氧化钠,向滤液中加入1mol/L盐酸200mL,沉淀量达到最大且质量为11.7g为Al(OH)3的质量,则根据铝原子守恒,c(AlO2﹣)= ![]() =
= ![]() =1.5molL﹣1 ,
=1.5molL﹣1 ,
最后所得的溶液中溶质为硫酸钠、氯化钠,根据钠离子守恒有n(NaOH)=n(NaCl)+2(Na2SO4),根据氯离子与硫酸根守恒有n(NaCl)=n(HCl)=0.2L×1mol/L=0.2mol,n(Na2SO4)=n(H2SO4)> ![]() n(Al2(SO4)3)=
n(Al2(SO4)3)= ![]() ×
× ![]() mol=0.225mol,故n(NaOH)=n(NaCl)+2(Na2SO4)>0.2mol+2×0.225mol=0.65mol,故c(Na+)>
mol=0.225mol,故n(NaOH)=n(NaCl)+2(Na2SO4)>0.2mol+2×0.225mol=0.65mol,故c(Na+)> ![]() =6.5mol/L,
=6.5mol/L,
所以答案是:1.5molL﹣1;6.5.


科目:高中化学 来源: 题型:
【题目】化学与生活生产密切相关,下列说法中不正确的是( )
A.电化学腐蚀和化学腐蚀都是金属被氧化的过程,伴随有电流产生
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.用锡焊接的铁质器件,焊接处容易生锈
D.电冶铝工业中用石墨作电极,用冰晶石作助熔剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的是( ) 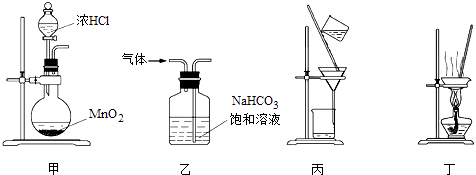
A.用装置甲制取氯气
B.用装置乙除去氯气中混有的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl24H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为元素周期表的一部分,请根据元素①﹣⑧在表中的位置,用化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是 (用化学式表示,下同);碱性最强的是 .
(2)④、⑤、⑥的简单离子半径由大到小的顺序是(用离子符号
(3)由①、④、⑤、三种元素组成的化合物中化学键的类型有: .
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族);
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
A ![]() B
B ![]() C
C
若A、B、C含同一金属元素,X为强电解质,且反应都在溶液中进行.B的化学式为 .
对应的反应①的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国城市环境中的大气污染物主要是
A、 O2、Cl2、HCl 、酸雨
B、 SO2、NO2、CO、烟尘
C、 NH3、CO、CO2、雾
D、 HCl、SO2、N2、粉尘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期元素X形成的单质A与NaOH溶液反应,有如下转化关系 ![]() ,(若产物中有水生成则省略未表示出来).
,(若产物中有水生成则省略未表示出来).
(1)若常温常压下,A为气态,且B、C中均有X元素,则A与NaOH溶液反应的离子方程式为;
(2)若常温常压下,A为非金属固态单质,且其在电子工业中有着重要的用途,则工业制取A化学方程式为;
(3)若A为金属,C为气体,则A 与NaOH溶液反应的离子方程式为
(4)由(2)和(3)中两种单质形成合金在工业、建筑业中有重要的用途.一个探究性学习小组,他们拟用该合金与足量稀硫酸的反应测定通常状况下气体摩尔体积,实验装置如下: 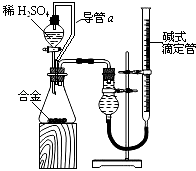
①装置中导管a的作用是平衡分液漏斗上下管口的压强,有利于液体滴下和;
②实验中准确测得4个数据:实验前该合金的质量m1g,实验后残留固体的质量m2g,实验前后碱式滴定管中液面读数分别为V1mL、V2mL;则通常状况时气体摩尔体积Vm=LmoL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 摩尔是物质的质量单位 B. 氢气的摩尔质量是2g
C. 1molOH—的质量是17g D. 气体摩尔体积就是1mol气体所占的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正确掌握化学用语是学好化学的基础,下列有关表述正确的是( )
A.H,D,T互为同素异形体
B.氨分子中的化学键为非极性共价键
C.NH4Cl的电子式: ![]()
D.S2﹣的结构示意图: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中正确的有
①沉淀中氢氧根的质量为(n-m)g
②恰好溶解后溶液中的NO3-的物质的量为![]() mol
mol
③反应过程中转移的电子的物质的量为![]() mol
mol
④生成NO气体的体积在标准状况下为![]() L
L
⑤与合金反应的硝酸的物质的量为![]() mol
mol
A. 5项 B. 4项 C. 3项 D. 2项
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com