
【题目】298 K时,![]() γ-羟基丁酸水溶液发生如下反应,生成
γ-羟基丁酸水溶液发生如下反应,生成![]() 丁内酯: HOCH2CH2CH2COOH
丁内酯: HOCH2CH2CH2COOH![]()
![]() +H2O
+H2O
不同时刻测得![]() 丁内酯的浓度如下表。
丁内酯的浓度如下表。
| 20 | 50 | 80 | 100 | 120 | 160 | 220 | ∞ |
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
注:该条件下副反应、溶液体积变化忽略不计。下列分析正确的是
A.增大γ-羟基丁酸的浓度可提高γ-丁内酯的产率
B.298 K时,该反应的平衡常数为2.75
C.反应至120 min时,γ-羟基丁酸的转化率<50%
D.80~120 min的平均反应速率:v(γ-丁内酯) >1.2×10-3 mol L-1min-1
科目:高中化学 来源: 题型:
【题目】在下列曲线中,纵坐标表示生成氢氧化铝的量,横坐标表示加入试剂的体积。从下边图中选出选项:
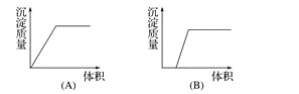
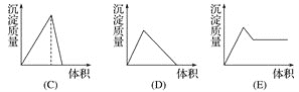
(1)向盐酸酸化的氯化铝溶液中逐滴滴入氨水至过量__________。
(2)向氢氧化钠与偏铝酸钠混合液中通入二氧化碳过量__________。
(3)向氨水中逐滴滴入氯化铝溶液至过量__________。
(4)向氯化铝溶液中滴加氢氧化钠至过量__________。
(5)向偏铝酸钠溶液滴加盐酸至过量______________。
(6)向氯化镁和氯化铝混合液中加氢氧化钠至过量____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M由两种元素组成,某研究小组按如图流程探究其组成:
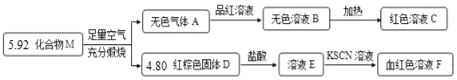
请回答:
(1)在制作印刷电路板的过程中常利用铜与溶液E的反应,反应的化学方程式为_____。
(2)将气体A通入溶液E中,溶液由黄色变成浅绿色,且酸性明显增强.写出该反应的离子方程式_____。
(3)化合物M的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列氧化还原反应:
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。
(1)该反应的还原剂是________,还原产物是________。
(2)该反应中氧化剂与氧化产物的物质的量之比是________。
(3)当有2 mol HNO3参加反应时,被氧化的物质是________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还有MgO等少量杂质)。提取铝的工业流程如下:
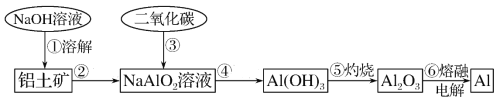
(1)铝是活泼金属,在干燥空气中铝的表面立即形成厚约5nm的致密氧化膜,写出用盐酸除去氧化膜的化学方程式___。
(2)氢氧化铝是用量最大、应用最广的无机阻燃添加剂,解释氢氧化铝能做阻燃剂的原因______(用方程式说明),写出第②步用到的玻璃仪器______。
(3)请用离子方程式表示以上工艺流程中第①步反应:__。
(4)实验室常选用试剂__(填写字母,a.氢氧化钠溶液,b.氨水)与硫酸铝溶液反应制取氢氧化铝,原因是__。
(5)写出氢氧化铝的其他用途(任写两条)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是一种应用广泛的金属,钠及其化合物在生产生活中应用广泛。某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。
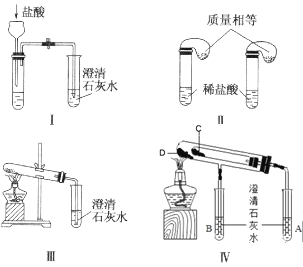
(1)只根据图中装置Ⅰ、Ⅱ所示实验,能够达到实验目的的是__(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式__、__;Ⅳ中现象为___;与实验Ⅲ相比,实验Ⅳ的优点___。
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管C中装入的固体是__(填化学式)。
(4)将适量钠投入下列溶液中,既能产生大量气体又能生成沉淀的是__(填写字母)
A.稀硫酸 B.氯化钠溶液 C.氯化镁溶液 D.硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若4.6 g Na在足量氧气中一段时间后,生成固体的质量为7.1 g,则生成的固体可能为( )
A.Na 和Na2OB.Na 和Na2O2C.Na 和Na2O2D.Na2O 和Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
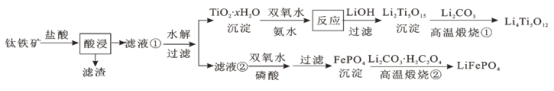
下列说法不正确的是
A.“酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl- = Fe2++ TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C.“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑
2LiFePO4+H2O+3CO2↑
温度/ | 30 | 35 | 40 | 45 | 50 |
TiO2 ·xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
D.TiO2 ·xH2O沉淀与双氧水、氨水反应40min所得实验结果如上表所示, 40 oC前,未达到平衡状态,随着温度升高,转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生课外活动小组,模拟呼吸面具中的反应原理,设计用如图所示的仪器来制取氧气并测量氧气的体积。图中量气装置E由甲、乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0—50mL),供量气用;乙管可上下移动调节液面高低。
实验可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。

试完成下列问题:
(1)图中各装置接口连接顺序是___(填各接口的编号,其中连接胶管及夹持装置均省略)。
(2)装置C中放入的两种反应物是____。
(3)装置A的作用是___,装置B的作用是___。
(4)为了较准确测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数及求其差值的过程中,应注意___(填字母编号,2项)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙两管液面相平
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com