
【题目】若4.6 g Na在足量氧气中一段时间后,生成固体的质量为7.1 g,则生成的固体可能为( )
A.Na 和Na2OB.Na 和Na2O2C.Na 和Na2O2D.Na2O 和Na2O2
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】已知草酸![]() 是一种弱酸,
是一种弱酸,![]() 升华,
升华,![]() 以上分解可放出
以上分解可放出![]() 和CO;可与酸性
和CO;可与酸性![]() 溶液反应;其钠盐易溶于水,钙盐难溶于水。下列说法正确的是
溶液反应;其钠盐易溶于水,钙盐难溶于水。下列说法正确的是![]()
![]()
A.草酸受热产生的气体,用足量的NaOH溶液充分吸收后,可收集得到纯净的CO
B.草酸受热产生的气体通过灼热的氧化铜,若出现黑色变红色现象,则说明产生的气体中一定有CO
C.草酸受热产生的气体直接通入足量的澄清石灰水中,若能产生白色浑浊现象,则说明产生的气体中一定有![]()
D.将![]() 草酸晶体
草酸晶体![]() 加入到
加入到![]() 的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是
的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是![]() 水解
水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,![]() γ-羟基丁酸水溶液发生如下反应,生成
γ-羟基丁酸水溶液发生如下反应,生成![]() 丁内酯: HOCH2CH2CH2COOH
丁内酯: HOCH2CH2CH2COOH![]()
![]() +H2O
+H2O
不同时刻测得![]() 丁内酯的浓度如下表。
丁内酯的浓度如下表。
| 20 | 50 | 80 | 100 | 120 | 160 | 220 | ∞ |
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
注:该条件下副反应、溶液体积变化忽略不计。下列分析正确的是
A.增大γ-羟基丁酸的浓度可提高γ-丁内酯的产率
B.298 K时,该反应的平衡常数为2.75
C.反应至120 min时,γ-羟基丁酸的转化率<50%
D.80~120 min的平均反应速率:v(γ-丁内酯) >1.2×10-3 mol L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1 mol/L的是( )
A. 将40gNaOH固体溶于1L水中
B. 将22.4 L氯化氢气体溶于水配成1L溶液
C. 将1L 10mol/L的浓盐酸与9L水混合
D. 将10g NaOH固体溶解在水中配成250 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应 2SO3(g)![]() 2SO2(g)+O2(g),将2 mol SO3通入2 L容积恒定的密闭容器中,若维持容器内温度不变,5 min末测得SO3的物质的量为0.8 mol。则下列说法正确的是
2SO2(g)+O2(g),将2 mol SO3通入2 L容积恒定的密闭容器中,若维持容器内温度不变,5 min末测得SO3的物质的量为0.8 mol。则下列说法正确的是
A.若某时刻消耗了1 molSO3同时生成了0.5molO2,则表明该反应达到了平衡状态
B.若起始时充入3 mol SO3,起始时SO3分解速率不变
C.0~5min,SO2的生成速率v(SO2)=0.12mol·L-1·min-1
D.达到平衡时,SO2和SO3的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用酒精和84消毒液混合使用可能发生反应:4NaClO+CH3CH2OH![]() HCCl3+HCOONa+NaCl+2NaOH+H2O,设NA为阿伏加德罗常数,下列叙述正确的是
HCCl3+HCOONa+NaCl+2NaOH+H2O,设NA为阿伏加德罗常数,下列叙述正确的是
A.含NA个ClO-的NaClO溶液中,Na+数目为NA
B.上述反应中,每生成1molNaCl,转移的电子数为8NA
C.100 g质量分数为46%的乙醇溶液中所含的氢原子数为6NA
D.标准状况下,2.24 L HCCl3含有的共用电子对的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
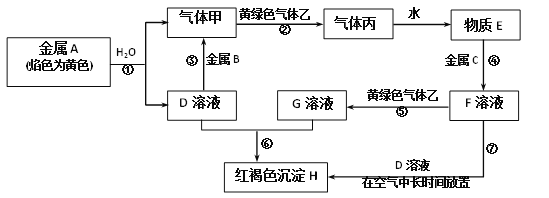
请根据以上信息完成下列各题:
(1)写出下列物质的化学式:B__________、丙__________。
(2)写出黄绿色气体乙的一种用途________________,反应过程⑦可能观察到的实验现象是_________________。
(3)写出反应①的化学方程式,并用单线桥法标出电子转移的方向和数目:______。
(4)反应③中的氧化剂是__________(写化学式,下同),反应④中的还原剂是________。
(5)写出反应⑤的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化镍在乙醇的悬浊液中可发生反应生成单质镍的配合物:Ni(OH)2+5CH3NC=(CH3NC)4Ni+CH3NCO+H2O。
(1)基态镍原子的未成对电子数为__,钯(Pd)与镍位于同一族,且Pd是Ni的下一周期元素,基态钯原子的未成对电子数为0,基态钯原子的外围电子排布式为___。
(2)CH3NCO中四种元素的第一电离能由大到小的顺序为___。CH3NC(结构简式为CH3—N≡C)分子中甲基碳原子的杂化轨道类型是___。
(3)用光气(COCl2)与甲胺(CH3NH2)可以制取CH3NCO。与COCl2互为等电子体的一种阴离子为___。
(4)如图,在镍的催化作用下,甲基呋哺与氨在高温下反应得到甲基吡咯。甲基吡咯的熔、沸点高于甲基呋喃的原因是_____________。
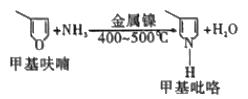
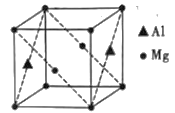
(5)(CH3NC)4Ni可作为储氢材料,某种镁铝合金也可作为储氢材料,该合金晶胞结构如图所示,晶胞棱长为anm,该合金的化学式为___,该晶体的密度为__g·cm-3(阿伏加德罗常数的数值用NA表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com