
【题目】铜与稀硝酸反应,不能生成的物质是( )
A.Cu(NO3)2
B.NO
C.H2O
D.H2
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案科目:高中化学 来源: 题型:
【题目】化学实验在学科中有举足轻重的作用,结合下列实验的图示分析相关的描述正确的是( )
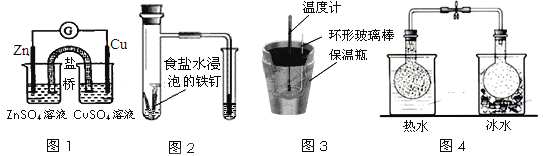
A. 图1:根据用电器(G)中指针的偏转方向可比较Zn、Cu的金属的活泼性
B. 图2:可根据小试管中液面的变化判断铁钉发生了析氢腐蚀
C. 图3:根据温度计读数的变化可测量浓硫酸和NaOH反应的中和热
D. 图4:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断2NO2(g)![]() N2O4(g)是一个吸热反应
N2O4(g)是一个吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A在无催化条件和有酶催化条件下生成物质P所需的能量变化如图,下列相关叙述正确的是( )
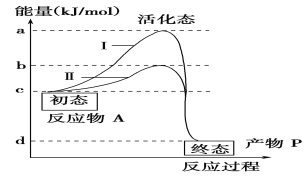
A. 若Ⅱ表示酶促反应曲线,则加热加压曲线应该在Ⅰ、Ⅱ之间
B. bd段表示在有酶催化剂条件下,物质A生成物质P化学反应顺利进行所提供的活化能
C. 若增加酶的量,则图中曲线的原有形状不发生改变
D. 曲线Ⅱ可表示最适酶促条件下的曲线,该反应只能在细胞内进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对Al2O3、Fe2O3的说法正确的是
A. 都是碱性氧化物 B. 都是白色、难溶于水的固体
C. 都能与NaOH溶液反应 D. 都能与盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的一半。下列说法正确的是( )
A. 原子半径:W>Z>Y>X>M
B. 将XZ2通入W单质与水反应后的溶液中,一定只生成一种盐
C. 由X、Y、Z、M四种元素形成的化合物中一定有共价键可能有离子键
D. CaX2、CaM2、CaZ2等3种化合物中,阳离子和阴离子个数比均为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
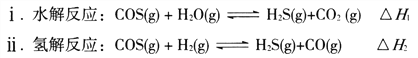
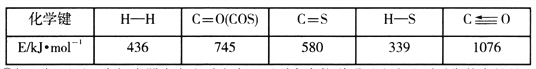
已知反应中相关的化学键键能数据如下表:
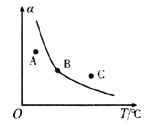
①一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(![]() )与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
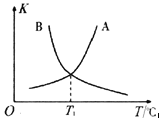
②反应ii的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示逆反应的平衡常数(K逆)的是__________(填“A”或“B”)。T1℃时,向容积为10 L的恒容密闭容器中充入2 mol COS(g)和1 mol H2(g),发生反应ii,COS的平衡转化率为_____________。
(2)过二硫酸是一种强氧化性酸,其结构式为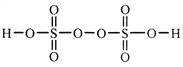
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为________________________。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵。总反应的离子方程式为________________________________。
(3)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。②Ksp(HgS)=_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世上万物、神奇可测,其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_____(填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为____,Q2+的未成对电子数是_____。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①制元素在周期表中的位置是______,[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为______。
②[Cu(NH3)4]SO4中,存在的化学键的类型有______(填字母)。
A离子键 B金属键 C.配位键 D.非极性键 E极性键
③NH3中N原子的杂化轨道类型是______,写出一种与SO42-互为等电子体的分子的化学式:_ ______。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物.则[Cu(NH3)4]2+的空间构型为_________。
(4)氧与铜形成的某种离子晶体的晶胞如图所示。则该化合物的化学式为_____,如果该晶体的密度为ρg/cm3,则该晶体内铜离子与氧离子间的最近距离为_____(用含ρ的代数式表示,其中阿伏加德罗常数用NA表示)cm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构及元素周期律的知识,下列推断正确的是( )
A. 核外电子排布相同的微粒化学性质也相同
B. Cl与Cl得电子能力相同
C. Cl-、S2-、Ca2+、K+半径逐渐减小
D. 同主族元素含氧酸的酸性随核电荷数的增加而减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com