
【题目】硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
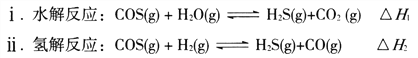
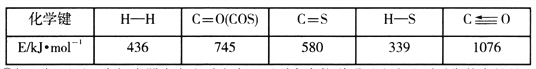
已知反应中相关的化学键键能数据如下表:
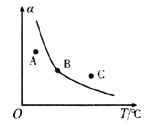
①一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(![]() )与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
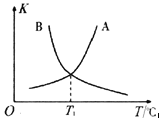
②反应ii的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示逆反应的平衡常数(K逆)的是__________(填“A”或“B”)。T1℃时,向容积为10 L的恒容密闭容器中充入2 mol COS(g)和1 mol H2(g),发生反应ii,COS的平衡转化率为_____________。
(2)过二硫酸是一种强氧化性酸,其结构式为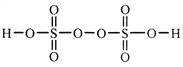
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为________________________。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵。总反应的离子方程式为________________________________。
(3)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。②Ksp(HgS)=_____________________。
【答案】 ABC B 33.3% ![]()
![]()
![]()
![]()
【解析】(1). ①跟据化学反应平均速率公式,COS和H2S的化学计量数相同,二者化学反应速率相等,在整个反应中,始终有v(COS)=v(H2S),故 ABC三点全部符合;②反应ii的焓变为:
745+580+436-339*2-1076kJ/mol=7 kJ/mol,正反应为吸热反应,温度升高有利于正反应进行,所以(K逆)为B;T1温度时,正逆反应化学平衡常数相等均为1,设反应达到平衡时转化COS为xmol/L,则容器中各物质的物质的量浓度为:c(COS)=(0.2-x)mol/L,c(H2)=(0.1-x)mol/L,c(H2S)=xmol/L,c(CO)=xmol/L, 由![]() ,可得x=1/15,则COS的平均转化率为:
,可得x=1/15,则COS的平均转化率为:![]() ;
;
(2). ① Ag+作为催化剂,S2O82-、Mn2+与水为反应物,SO42-和MnO4-为生成物,同时生成H+,离子方程式为:![]() ;②由题意得出反应方程式为:H2SO4+(NH4)2SO4
;②由题意得出反应方程式为:H2SO4+(NH4)2SO4![]() (NH4)2S2O8+H2↑,写成离子反应方程式为:2H++2SO42—
(NH4)2S2O8+H2↑,写成离子反应方程式为:2H++2SO42—![]() S2O82-+H2↑;
S2O82-+H2↑;
(3). ①S原子核外电子最外层有6个电子,其与H原子共用一对电子,从Na原子获得一个电子,从而形成稳定结构,电子式为![]() ;反应的平衡常数
;反应的平衡常数![]() ,则
,则![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知烯烃经臭氧氧化后,在Zn存在下水解,可得醛或酮.如:![]() ,现有化学式为C10H20的烯烃,它经臭氧氧化后在Zn存在下水解只生成一种有机物,符合该条件的结构共有( )种
,现有化学式为C10H20的烯烃,它经臭氧氧化后在Zn存在下水解只生成一种有机物,符合该条件的结构共有( )种
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的无机化工产品之一,在国民经济中占有重要地位。我国采用铁触媒(以铁为主的混合物)做催化剂合成氨。回答下列问题:
(1)Fe基态原子核外电子排布式为____。氮化铁是一种重要的无机化合物,不溶于水,暴露在潮湿环境中可释放出氨气,元素Fe和N中,第一电离能较大的是_____,基态原子核外未成对电子数较多的是_______。
(2)N的氧化物有N2O等,N2O与CO2互为等电子体,N2O的空间构型为__________。
(3)N有多种氢化物,其中肼(N2H4)常用作火箭推进剂的燃料,N2H4中N原子的杂化形式为____。
(4)N、P、As为同族元素,NH3、PH3、AsH3三种物质的沸点由高到低的顺序为_____。原因是____。
(5)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中存在的化学键类型有_______。
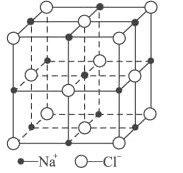
(6)FeO晶体的晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为428pm,则该晶体的密度为____g/cm3(列出计算式即可,用NA表示阿伏加德罗常数的值)。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙二醇(PEG) 是一种用途广泛的聚合物,1,2-乙二醇碳酸酯(又称为碳酸亚乙酯) 是一种医药中间体。某小组以烃A 为原料合成PEG和碳酸亚乙酯的路线设计如下:
已知: 2C2H5OH+CO+1/2O2 ![]() C2H5OCOOC2H5+H2O
C2H5OCOOC2H5+H2O
回答下列问题:
(1)A的名称为____________; A→B的反应类型为__________;C 的核磁共振氢谱中峰面积比为___________;F的分子式为____________________。
(2)B→C的化学方程式为____________。
(3)C在一定条件下发生聚合反应生成PEC,化学方程式为___________________;若某种PEG的平均相对分子质量为2000, 则其平均聚合度为____________________。
(4)E的同分异构体中,含有—OCOO—基团的共有___种(不包含E和立体异构)。
(5)有人认为C和E生成F的反应历程可能如下:
①HOCH2CH2OH + CO32-![]() HOCH2CH2O-+HCO3-
HOCH2CH2O-+HCO3-
②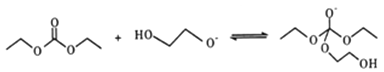
③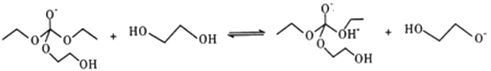
④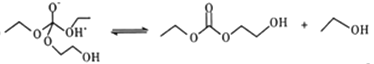
⑤
⑥⑦⑧……
⑨HOCH2CH2O- +HCO3-→HOCH2CH2OH+CO32-
写出上述历程中⑥⑦⑧的反应方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.甲烷性质稳定,但能使酸性高锰酸钾溶液褪色
B.甲烷的空间构型是平面正方形
C.通式为CnH2n+2的烃不一定是烷烃
D.碳原子个数小于5的烷烃常温下均为气态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com