
【题目】实验是学习化学的一个重要途径。
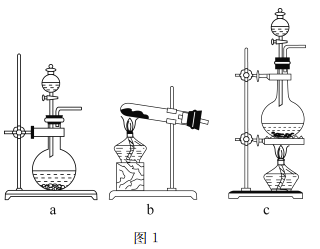
(1)图1是实验室常用的制气装置,其中b可用于制取O2和NH3,实验室用装置b制取NH3反应的化学方程式为______________________________________。若用二氧化锰和浓盐酸制取氯气应选择的装置为_______,反应的离子方程式为_____________________________。
(2)图2是实验室制备氯气并进行一系列相关实验的装置。
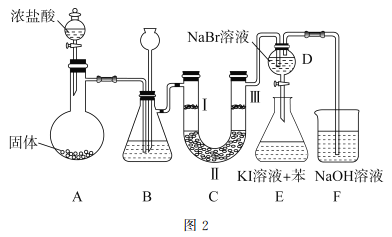
①装置B中盛装的液体试剂为_________。
②装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、II处依次放入的物质正确的是_________(填字母编号)。
编号 | I | II | III |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
③D中发生反应的离子方程式是_________。将装置D中的溶液加入装置E中,溶液分为两层,上层呈紫红色,要分离出紫红色溶液,需使用的玻璃仪器是玻璃棒、烧杯和________。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2OcMnO2+4H++2Cl-
CaCl2+2NH3↑+2H2OcMnO2+4H++2Cl-![]() Cl2↑+Mn2++2H2O饱和食盐水dCl2+2Br-=Br2+2Cl-分液漏斗
Cl2↑+Mn2++2H2O饱和食盐水dCl2+2Br-=Br2+2Cl-分液漏斗
【解析】
(1)由于b装置为“固+固![]() 气”型,则采用消石灰与氯化铵固体反应来制备,方程式为2NH4Cl+Ca(OH)2
气”型,则采用消石灰与氯化铵固体反应来制备,方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;二氧化锰和浓盐酸制取氯气需要加热,应选用装置c,离子方程式为: MnO2+4H++2Cl-
CaCl2+2NH3↑+2H2O;二氧化锰和浓盐酸制取氯气需要加热,应选用装置c,离子方程式为: MnO2+4H++2Cl-![]() Cl2↑+Mn2++2H2O;(2)①用浓盐酸制取的Cl2中含有HCl,所以装置B中饱和食盐水的作用是除去Cl2中的HCl,故答案为:饱和食盐水;②为了验证氯气是否具有漂白性,I中加入湿润的有色布条,II为U型管,可加入固体干燥剂,得到干燥的Cl2,III中加入干燥的有色布条,即可证明Cl2是否具有漂白性,故答案为D;③Cl2通入D与NaBr反应生成Br2,则离子反应为:Cl2+2Br-=Br2+2Cl-,分离出E中两层液体的操作为分液,需要的玻璃仪器有烧杯和分液漏斗,故答案为:Cl2+2Br-=Br2+2Cl-、分液漏斗。
Cl2↑+Mn2++2H2O;(2)①用浓盐酸制取的Cl2中含有HCl,所以装置B中饱和食盐水的作用是除去Cl2中的HCl,故答案为:饱和食盐水;②为了验证氯气是否具有漂白性,I中加入湿润的有色布条,II为U型管,可加入固体干燥剂,得到干燥的Cl2,III中加入干燥的有色布条,即可证明Cl2是否具有漂白性,故答案为D;③Cl2通入D与NaBr反应生成Br2,则离子反应为:Cl2+2Br-=Br2+2Cl-,分离出E中两层液体的操作为分液,需要的玻璃仪器有烧杯和分液漏斗,故答案为:Cl2+2Br-=Br2+2Cl-、分液漏斗。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】下列关于反应2Na2O2+2H2O=4NaOH+O2↑的说法正确的是( )
A. 过氧化钠是氧化剂,水是还原剂 B. 过氧化钠是还原剂,水是氧化剂
C. 过氧化钠既是氧化剂又是还原剂 D. 水既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入30 mL浓度为10.00 mol·L-1的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
A. 与NaOH反应的氯气一定为0.3 mol
B. n(Na+)∶n(Cl-)可能为7∶3
C. 若反应中转移的电子为n mol,则0.15<n<0.25
D. n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于吸热反应的是( )
A. C6H12O6(葡萄糖aq)+6O2![]() 6CO2+6H2O
6CO2+6H2O
B. 氢氧化钠溶液与盐酸的中和反应
C. 反应物的总能量大于生成物的总能量
D. 破坏反应物全部化学键所需能量大于破坏生成物全部化学键所需能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铯的叙述正确的是( )
A. 硫酸铯是一种难溶性离子化合物
B. 碳酸氢铯加热能迅速分解,碳酸铯受热不分解
C. 铯能在氧气中燃烧生成氧化铯
D. 在自然界中有少量游离态的铯存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
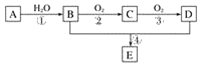
图1
(1)写出下列物质的官能团名称:
B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。
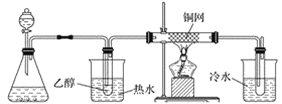
甲 乙 丙 丁
图2
①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A Na2O2 B KCl C Na2CO3 D MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体。
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。
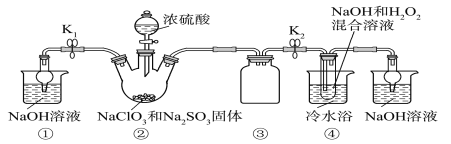
(1)装置①的作用是_______________
(2)装置②中产生ClO2气体的化学方程式为____________。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55 ℃蒸发结晶;
②趁热过滤;
③____________________________________;
④低于60 ℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。设计如下实验方案,并进行实验。
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+===2H2O+2I2+Cl-)。将所得混合液配成100 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-===2I-+S4O62-)。
(4)样品中NaClO2的质量分数为__________(用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:

回答下列问题:.
(1)固体1含有的物质是_________、CaCO3、Ca(OH)2;捕获剂所捕获的气体主要是_______________。
(2)若X是空气,则上述反应中NO和O2的物质的量之比最好为___________,若空气过量,导致的结果会是____________________________。
(3)流程中处理含NH4+废水时发生反应的离子方程式为____________________________。气体1也可通过催化剂直接转化成无污染气体,反应的化学方程式为_____________________________________。
(4)若工业废气中主要含N2、SO2,不考虑其他成分,则可用下列工艺生产NaHSO3过饱和溶液[NaHSO3过饱和溶液是生产焦亚硫酸钠(Na2S2O5)的原料]。
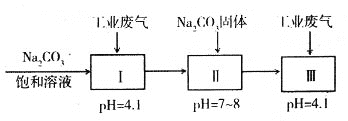
pH=4.1时,I中反应的化学方程式为_________________________;工艺中加入Na2CO3
固体、并再次通入废气的目的是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应达到最大反应限度的本质特征是( )
A.正反应不再继续进行
B.正反应和逆反应都再继续进行
C.正反应和逆反应的速率都为零
D.正反应和逆反应的速率相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com