
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体。
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。
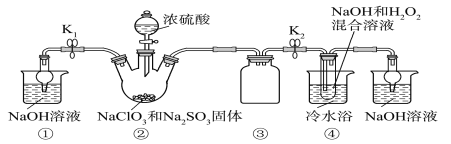
(1)装置①的作用是_______________
(2)装置②中产生ClO2气体的化学方程式为____________。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55 ℃蒸发结晶;
②趁热过滤;
③____________________________________;
④低于60 ℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。设计如下实验方案,并进行实验。
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+===2H2O+2I2+Cl-)。将所得混合液配成100 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-===2I-+S4O62-)。
(4)样品中NaClO2的质量分数为__________(用含m、c、V的代数式表示)。
【答案】吸收多余的ClO2气体,防止污染环境 2NaClO3+Na2SO3+H2SO4(浓)===2ClO2↑+2Na2SO4+H2O 用38~60 ℃的温水洗涤 ![]()
【解析】
(1)装置①中装有氢氧化钠溶液,其作用是吸收多余的ClO2气体,防止污染环境;
(2)亚硫酸钠具有还原性,在反应中作还原剂;装置②中产生ClO2的反应是氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯,反应的化学方程式应为2NaClO3+Na2SO3+H2SO4(浓)===2ClO2↑+2Na2SO4+H2O;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO23H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,故答案为:用38℃~60℃热水洗涤;
(4)由关系式为ClO2---2I2--4S2O32-,n(ClO2-)=![]() n(S2O32-)=
n(S2O32-)=![]() ×V×10-3×c=2.5cV×10-4mol,m(NaClO2)=2.5cV×10-4mol×90.5g/mol,
×V×10-3×c=2.5cV×10-4mol,m(NaClO2)=2.5cV×10-4mol×90.5g/mol,
样品中NaClO2的质量分数=![]() 。
。


科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是高铁电池的重要原料,也是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
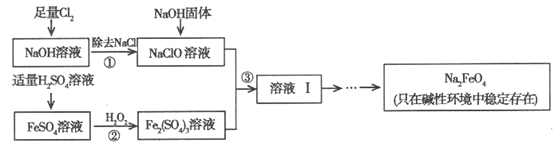
回答下列问题:
(1)Cl2与NaOH溶液反应的离子方程式是__________________。
(2)经过步骤①后,加入NaOH固体的原因是________________________。
(3)步骤②反应的离子方程式是_______________。
(4)从溶液I中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为_______________。
(5)Na2FeO4投入到污水中杀菌消毒,生成的Fe(OH)3可以起到絮凝剂的作用。通过计算得知Na2FeO4的消毒效率(以单位质量的消毒剂得到的电子数表示)比氯气的_________(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是_________(答出一点即可)。
(6)高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH放电时,负极的电极反应式是_____。正极附近溶液的碱性______(填“增强”、“不变”或“减弱”)。
3Zn(OH)2+2Fe(OH)3+4KOH放电时,负极的电极反应式是_____。正极附近溶液的碱性______(填“增强”、“不变”或“减弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个图像,以下反应中完全符合上述图像的是( )
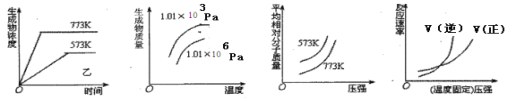
A. N2(g) +3H2 (g) ![]() 2NH3 (g) △H<O
2NH3 (g) △H<O
B. 2SO3 (g) ![]() 2SO2 (g) +O2 (g) △H>O
2SO2 (g) +O2 (g) △H>O
C. 4NH3 (g) +5O2 (g) ![]() 4NO (g) +6H2O (g) △H<O
4NO (g) +6H2O (g) △H<O
D. CO2(g) +NO(g) ![]() CO(g)+NO2(g) △H>O
CO(g)+NO2(g) △H>O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是学习化学的一个重要途径。
(1)图1是实验室常用的制气装置,其中b可用于制取O2和NH3,实验室用装置b制取NH3反应的化学方程式为______________________________________。若用二氧化锰和浓盐酸制取氯气应选择的装置为_______,反应的离子方程式为_____________________________。
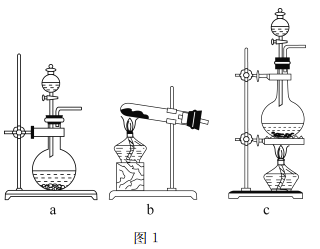
(2)图2是实验室制备氯气并进行一系列相关实验的装置。
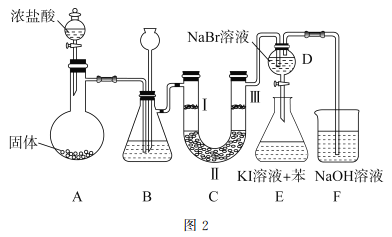
①装置B中盛装的液体试剂为_________。
②装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、II处依次放入的物质正确的是_________(填字母编号)。
编号 | I | II | III |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
③D中发生反应的离子方程式是_________。将装置D中的溶液加入装置E中,溶液分为两层,上层呈紫红色,要分离出紫红色溶液,需使用的玻璃仪器是玻璃棒、烧杯和________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,浓度均为1 molL-1的A2和B2两种气体,在密闭容器中反应生成气体C,反应达到平衡后,测得:c(A2)="0.58" molL-1,c(B2)="0.16" molL-1,c(C)=0.84molL-1,则该反应的正确表达式为:
A. 2A2+B2![]() 2A2B B. A2+B2
2A2B B. A2+B2![]() 2AB
2AB
C. A2+B2![]() A2B2 D. A2+2B2
A2B2 D. A2+2B2![]() 2AB2
2AB2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、As的化合物。由黑钨矿冶炼钨的工艺流程如下:

已知:
①滤渣I的主要成份是Fe2O3、MnO2。
②上述流程中,钨的化合价只有在最后一步发生改变。
③常温下钨酸难溶于水。
(1)请写出FeWO4在熔融条件下发生碱分解反应生成Fe2O3的化学方程式:______________________________________。
(2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子为SiO32―、HAsO32―、HAsO42―等,则“净化”过程中,加入H2O2时发生反应的离子方程式为_________,滤渣Ⅱ的主要成分是______________。
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。

①T1_____T2(填“>”或“<”)T1时Ksp(CaWO4)=______________。
②将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质内所含的杂质(括号内的物质),所选用的试剂不正确的是 ( )
A.乙酸(苯甲酸):NaOH溶液B.甲烷(乙烯):溴水
C.苯(苯甲酸):NaOH溶液D.乙炔(硫化氢):亚硫酸钠酸性溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B. 2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
C. 加热0.1 mol·L-1Na2CO3溶液,CO![]() 的水解程度和溶液的pH均增大
的水解程度和溶液的pH均增大
D. 对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com