
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是高铁电池的重要原料,也是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
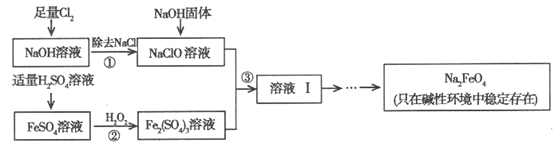
回答下列问题:
(1)Cl2与NaOH溶液反应的离子方程式是__________________。
(2)经过步骤①后,加入NaOH固体的原因是________________________。
(3)步骤②反应的离子方程式是_______________。
(4)从溶液I中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为_______________。
(5)Na2FeO4投入到污水中杀菌消毒,生成的Fe(OH)3可以起到絮凝剂的作用。通过计算得知Na2FeO4的消毒效率(以单位质量的消毒剂得到的电子数表示)比氯气的_________(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是_________(答出一点即可)。
(6)高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH放电时,负极的电极反应式是_____。正极附近溶液的碱性______(填“增强”、“不变”或“减弱”)。
3Zn(OH)2+2Fe(OH)3+4KOH放电时,负极的电极反应式是_____。正极附近溶液的碱性______(填“增强”、“不变”或“减弱”)。
【答案】Cl2+2OH-=Cl-+ClO-+H2O Na2FeO4只在碱性环境中稳定存在,NaOH调节pH 2Fe2++2H++H2O2=2Fe3++2H2O 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O 低 方便保存,消毒的同时可以净水,无毒 Zn-2e-+2OH-=Zn(OH)2, 增强
【解析】
(1)Cl2与NaOH溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O;
(2)经过步骤①后,加入NaOH固体的原因是Na2FeO4只在碱性环境中稳定存在,NaOH调节pH;
(3)步骤②硫酸亚铁在双氧水作用下被氧化生成硫酸铁和水,反应的离子方程式是2Fe2++2H++H2O2=2Fe3++2H2O;
(4)从溶液I中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中硫酸铁在碱性条件下被次氯酸钠氧化生成高铁酸钠,反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(5)FeO42-+3e-+4H2OFe(OH)3+5OH-,单位质量得到电子![]() =0.018,
=0.018,
Cl2+2e-═2Cl-,单位质量得到电子![]() =0.028,
=0.028,
所以Na2FeO4的消毒效率比氯气低;高铁酸钠代替氯气作净水消毒剂,利用氧化性起到杀菌消毒作用,利用生成的氢氧化铁胶体起到净水作用,答案为方便保存,消毒的同时可以净水,无毒;
(6)放电时,负极上锌失电子发生氧化反应,电极反应式为Zn-2e-+2OH-=Zn(OH)2;正极K2FeO4发生得电子的还原反应,即FeO42-+3e-+4H2O=Fe(OH)3+5OH-,正极附近溶液的碱性增强。


科目:高中化学 来源: 题型:
【题目】鸦片具有复杂的组成,其中的罂粟碱的分子结构如图。鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾,使人体质衰弱,精神颓废,寿命缩短。已知该物质的燃烧产物为CO2、H2O和N2,1 mol该化合物完全燃烧消耗O2的物质的量及在一定条件下与Br2发生苯环取代反应生成的一溴代物同分异构体的种数分别是
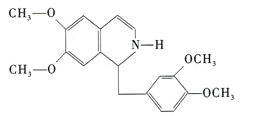
A. 23.75 mol;5 B. 24.5 mol;7 C. 24.5 mol;8 D. 23.75 mol;4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用反应Cu+2FeCl3=CuCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是( )
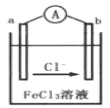
A. b为负极,发生还原反应
B. b电极反应式为2Fe3++2e-=Fe2+
C. 电子流动方向是a电极→FeCl3溶液→b电极
D. 电池的正极材料可以选用石墨、铂电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应2Na2O2+2H2O=4NaOH+O2↑的说法正确的是( )
A. 过氧化钠是氧化剂,水是还原剂 B. 过氧化钠是还原剂,水是氧化剂
C. 过氧化钠既是氧化剂又是还原剂 D. 水既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 丙烷和丁烷互称为同系物
B. ![]() 的名称为3-甲基丁烷
的名称为3-甲基丁烷
C. 沸点:正丁烷>异丁烷>丙烷
D. CH3CH2CH2CH3和CH3CH(CH3)2互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属Na、Mg、Al有广泛的应用。
(1)Al在元素周期表中的位置是__________________。
(2)金属镁可以用来生产金属铀(元素符号是U):UF4+2Mg![]() U+2MgF2,该反应中,作为还原剂的物质是_________(填化学式,下同),被还原的物质是_________。
U+2MgF2,该反应中,作为还原剂的物质是_________(填化学式,下同),被还原的物质是_________。
(3)为比较Na、Mg、Al的金属性,进行了如下实验(金属固体的表面积都相同):
实验1 | 实验2 |
|
|
钠与水反应剧烈,镁与水反应缓慢 | 镁与盐酸反应剧烈,铝与盐酸反应缓慢 |
由实验1和实验2得出的结论是:金属性_________>_________>_________(填元素符号),用原子结构理论解释:同周期元素从左到右,_________。
(4)把镁条(去除氧化膜)投入到盛有盐酸的敞口容器中,产生H2的速率v与时间t的关系如图所示,AB段速率增大的主要原因是__________________。
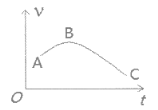
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入30 mL浓度为10.00 mol·L-1的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
A. 与NaOH反应的氯气一定为0.3 mol
B. n(Na+)∶n(Cl-)可能为7∶3
C. 若反应中转移的电子为n mol,则0.15<n<0.25
D. n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体。
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。
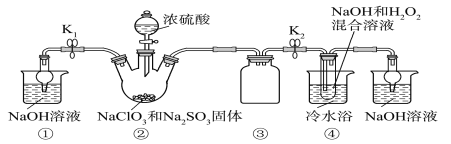
(1)装置①的作用是_______________
(2)装置②中产生ClO2气体的化学方程式为____________。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55 ℃蒸发结晶;
②趁热过滤;
③____________________________________;
④低于60 ℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。设计如下实验方案,并进行实验。
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+===2H2O+2I2+Cl-)。将所得混合液配成100 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-===2I-+S4O62-)。
(4)样品中NaClO2的质量分数为__________(用含m、c、V的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com