
【题目】金属Na、Mg、Al有广泛的应用。
(1)Al在元素周期表中的位置是__________________。
(2)金属镁可以用来生产金属铀(元素符号是U):UF4+2Mg![]() U+2MgF2,该反应中,作为还原剂的物质是_________(填化学式,下同),被还原的物质是_________。
U+2MgF2,该反应中,作为还原剂的物质是_________(填化学式,下同),被还原的物质是_________。
(3)为比较Na、Mg、Al的金属性,进行了如下实验(金属固体的表面积都相同):
实验1 | 实验2 |
|
|
钠与水反应剧烈,镁与水反应缓慢 | 镁与盐酸反应剧烈,铝与盐酸反应缓慢 |
由实验1和实验2得出的结论是:金属性_________>_________>_________(填元素符号),用原子结构理论解释:同周期元素从左到右,_________。
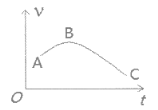
(4)把镁条(去除氧化膜)投入到盛有盐酸的敞口容器中,产生H2的速率v与时间t的关系如图所示,AB段速率增大的主要原因是__________________。
【答案】第三周期IIIA Mg UF4 Na Mg Al 原子半径减小,失电子能力减弱 该反应放热,使反应体系温度升高
【解析】
(1)Al为27号元素,在元素周期表中的位置是第三周期IIIA族;
(2)反应UF4+2Mg![]() U+2MgF2中,Mg由0价变为+2价,作为还原剂的物质是Mg,U由+4价变为0价,被还原,故被还原的物质是UF4;
U+2MgF2中,Mg由0价变为+2价,作为还原剂的物质是Mg,U由+4价变为0价,被还原,故被还原的物质是UF4;
(3)实验1:取1.0 g金属钠和镁,分别加入到5 mL水中,钠与水反应剧烈,镁与水反应缓慢,说明钠比镁活泼;实验2:取1.0 g的镁条和铝条,分别加入到5 mL 1.0 mol/L盐酸中,镁与盐酸反应剧烈,铝与盐酸反应较剧烈,说明镁比铝活泼,综上可得结论:金属的活泼性Na>Mg>Al;同周期从左到右,原子半径逐渐减小,失电子能力逐渐减弱;
(4)镁与盐酸反应,AB段时刻,盐酸浓度不断减少,反应速率应减小,但反应放热,温度升高,且总体反应速率呈不断增大的趋势,说明影响AB段反应速率的主要因素是温度。答案为该反应放热,使反应体系温度升高,AB段速率增大。


科目:高中化学 来源: 题型:
【题目】下列关于原子的认识正确的是( )
A.原子是构成一切物质的最小微粒
B.原子是不可再分的一种微粒
C.原子是化学变化中的最小微粒
D.所有原子的原子核内均有质子和中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向恒温恒压容器中充入2 mol NO、1 mol O2,发生反应:2NO(g)+O2(g) ![]() 2NO2(g)。下列情况不能说明反应已达到平衡状态的是( )
2NO2(g)。下列情况不能说明反应已达到平衡状态的是( )
A. 容器体积不再改变 B. 混合气体的颜色不再改变
C. 混合气体的密度不再改变 D. NO与O2的物质的量的比值不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法正确的是
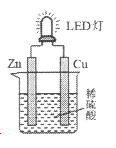
A. 溶液中的SO42-向铜极移动
B. 锌片为原电池的负极,发生还原反应
C. 如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D. 铜片表面有气泡生成,发生的反应为:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是高铁电池的重要原料,也是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
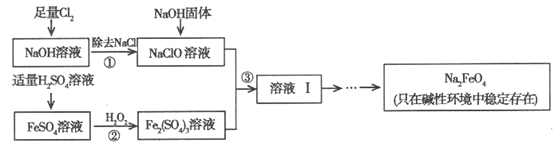
回答下列问题:
(1)Cl2与NaOH溶液反应的离子方程式是__________________。
(2)经过步骤①后,加入NaOH固体的原因是________________________。
(3)步骤②反应的离子方程式是_______________。
(4)从溶液I中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为_______________。
(5)Na2FeO4投入到污水中杀菌消毒,生成的Fe(OH)3可以起到絮凝剂的作用。通过计算得知Na2FeO4的消毒效率(以单位质量的消毒剂得到的电子数表示)比氯气的_________(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是_________(答出一点即可)。
(6)高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH放电时,负极的电极反应式是_____。正极附近溶液的碱性______(填“增强”、“不变”或“减弱”)。
3Zn(OH)2+2Fe(OH)3+4KOH放电时,负极的电极反应式是_____。正极附近溶液的碱性______(填“增强”、“不变”或“减弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g)![]() H2(g)+I2(g)△H > 0,H2物质的量随时间的变化如图所示。
H2(g)+I2(g)△H > 0,H2物质的量随时间的变化如图所示。
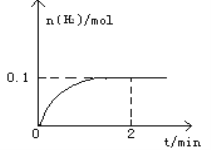
(1)2 min时HI的转化率a(HI)=____________________。该温度下,H2(g)+I2(g)![]() 2HI(g)的平衡常数K=________________。
2HI(g)的平衡常数K=________________。
(2)下列哪种情况能说明该反应已经达到平衡状态(___________)
A.气体的密度不再变化了
B.气体的颜色不再变化了
C.气体的总压强不再变化了
D.相同时间内消耗氢气的质量和生成碘的质量相等
E.单位时间内消耗氢气和消耗碘化氢的物质的量相等
F.氢气的质量分数不变了
(3)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g) ![]() 2C(g)+D(s)反应,该反应的平衡常数的表达式K=____________________,按下表数据投料:
2C(g)+D(s)反应,该反应的平衡常数的表达式K=____________________,按下表数据投料:
物质 | A | B | C | D |
起始投料/mol | 2 | 1 | 2 | 0 |
反应达到平衡状态,测得体系压强升高。该反应△H____0(填“>”、“<” 或者“=”),简述该反应的平衡常数与温度的变化关系:__________________________________________________。
(4)该反应如果把D的物质的量增大一倍,逆反应速率________(填“增大”、“减小” 或者“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法不正确的是( )
A.乙醇和乙酸都是常用调味品的成分
B.乙醇、乙烷和乙酸都可与钠反应生成氢气
C.“酒越陈越香”与酯化反应有关
D.乙醇与甲醚(CH3OCH3)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、As的化合物。由黑钨矿冶炼钨的工艺流程如下:

已知:
①滤渣I的主要成份是Fe2O3、MnO2。
②上述流程中,钨的化合价只有在最后一步发生改变。
③常温下钨酸难溶于水。
(1)请写出FeWO4在熔融条件下发生碱分解反应生成Fe2O3的化学方程式:______________________________________。
(2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子为SiO32―、HAsO32―、HAsO42―等,则“净化”过程中,加入H2O2时发生反应的离子方程式为_________,滤渣Ⅱ的主要成分是______________。
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。

①T1_____T2(填“>”或“<”)T1时Ksp(CaWO4)=______________。
②将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com