
【题目】某同学利用反应Cu+2FeCl3=CuCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是( )
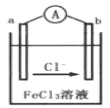
A. b为负极,发生还原反应
B. b电极反应式为2Fe3++2e-=Fe2+
C. 电子流动方向是a电极→FeCl3溶液→b电极
D. 电池的正极材料可以选用石墨、铂电极
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】稀有金属钌(Ru)的性质很稳定,耐腐蚀。实验室用H2还原RuO2来制备金属钌的装置如图所示。下列说法错误的是
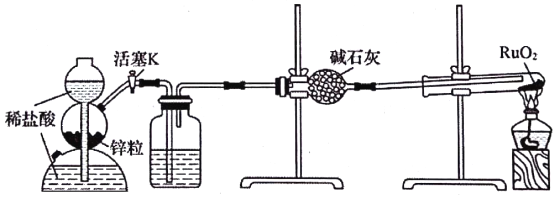
A. 加热RuO2前,应先收集气体并点燃,通过声音判断气体纯度
B. 洗气瓶中盛装的可能是NaOH溶液,用于除去挥发出来的HCl气体
C. 结束反应时,先停止加热,待试管冷却到室温后再关闭活塞K
D. 启普发生器也可用于碳酸钠晶体与稀硫酸反应制备二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+比B3+多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E与C同主族且处于C的下两个周期。试回答:
(1)A是________(写元素符号),D是________(写元素名称).
(2)B的离子结构示意图________,A的单质分子的电子式__________,C元素最高价氧化物对应的水化物的电子式________。
(3)用电子式表示H2A形成过程:____________________。
(4)写出CD的溶液中通入氯气的离子方程式:_______________
(5)比较B、C、E三种元素形成的简单离子的半径大小:(B、C、E离子用实际离子符号表示) ________ > __________ > __________ 。
(6) 比较C 、E 两元素最高价氧化物对应的水化物的碱性强弱(用化学式表示)________ > __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项反应对应的图像正确的是
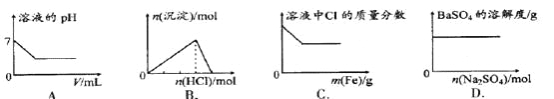
A. 25℃时,向亚硫酸溶液中通入氯气
B. 向 Na[Al(OH)4]溶液中通入 HCl气体
C. 向少量氯化铁溶液中加入铁粉
D. 向 BaSO4饱和溶液中加入硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把浓硫酸滴入浓盐酸中会有氯化氢气体逸出,对此现象的合理解释是( )
A.氯化氢难溶于水
B.浓硫酸是一种高沸点的酸
C.浓硫酸有脱水性
D.浓硫酸溶于水放出大量的热,降低了氯化氢的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向恒温恒压容器中充入2 mol NO、1 mol O2,发生反应:2NO(g)+O2(g) ![]() 2NO2(g)。下列情况不能说明反应已达到平衡状态的是( )
2NO2(g)。下列情况不能说明反应已达到平衡状态的是( )
A. 容器体积不再改变 B. 混合气体的颜色不再改变
C. 混合气体的密度不再改变 D. NO与O2的物质的量的比值不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,回答下列问题:
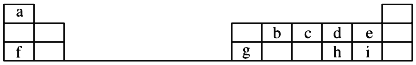
(1)元素e的负一价离子的结构示意图为__________,f、g、h、i对应简单离子的半径由大到小的顺序为____________________(用具体微粒符号表示)。
(2)元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为____。
(3)b、c、d三种原子的得电子能力大小顺为_____________________(用具体微粒符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是高铁电池的重要原料,也是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
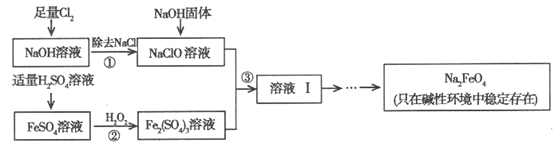
回答下列问题:
(1)Cl2与NaOH溶液反应的离子方程式是__________________。
(2)经过步骤①后,加入NaOH固体的原因是________________________。
(3)步骤②反应的离子方程式是_______________。
(4)从溶液I中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为_______________。
(5)Na2FeO4投入到污水中杀菌消毒,生成的Fe(OH)3可以起到絮凝剂的作用。通过计算得知Na2FeO4的消毒效率(以单位质量的消毒剂得到的电子数表示)比氯气的_________(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是_________(答出一点即可)。
(6)高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH放电时,负极的电极反应式是_____。正极附近溶液的碱性______(填“增强”、“不变”或“减弱”)。
3Zn(OH)2+2Fe(OH)3+4KOH放电时,负极的电极反应式是_____。正极附近溶液的碱性______(填“增强”、“不变”或“减弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个图像,以下反应中完全符合上述图像的是( )
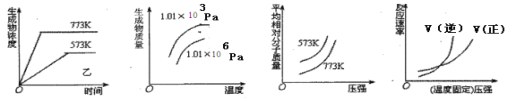
A. N2(g) +3H2 (g) ![]() 2NH3 (g) △H<O
2NH3 (g) △H<O
B. 2SO3 (g) ![]() 2SO2 (g) +O2 (g) △H>O
2SO2 (g) +O2 (g) △H>O
C. 4NH3 (g) +5O2 (g) ![]() 4NO (g) +6H2O (g) △H<O
4NO (g) +6H2O (g) △H<O
D. CO2(g) +NO(g) ![]() CO(g)+NO2(g) △H>O
CO(g)+NO2(g) △H>O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com