
【题目】把浓硫酸滴入浓盐酸中会有氯化氢气体逸出,对此现象的合理解释是( )
A.氯化氢难溶于水
B.浓硫酸是一种高沸点的酸
C.浓硫酸有脱水性
D.浓硫酸溶于水放出大量的热,降低了氯化氢的溶解度
 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】CuBr是一种白色晶体,见光或潮湿时受热易分解,在空气中逐渐变为浅绿色。实验室制备CuBr的反应原理为:SO2+2CuSO4+2NaBr+ 2H2O=2CuBr↓+2H2SO4+Na2SO4,用下列装置进行实验,不能达到实验目的的是
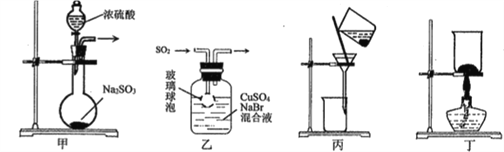
A. 用装置甲制取SO2 B. 用装置乙制取CuBr
C. 用装置丙避光将CuBr与母液分离 D. 用装置丁干燥CuBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)![]() 2NH3(g)
2NH3(g)
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N≡N |
435.9kJ | 390.8kJ | 192.8kJ | 945.8kJ |
(1)则反应物的总能量_________(填“>”或 “<”)生成物的总能量
(2)在一定温度下、向2L密闭容器中加入2 molN2、6 mol H2,在适当的催化剂作用下,发生反应 N2 (g)+3H2 (g)![]() 2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
①下列叙述能说明此反应达到平衡状态的是____。
a.容器内总压强不变 b.v(H2)正=v(H2)逆 c.N2和H2的浓度相等
d. 2 mol NH3生成的同时有3 moH—H键断裂 e.NH3的浓度不再改变
②0~10 min内的平均反应速率v(H2) 是____mol/(Lmin);10秒末NH3的浓度是___mol/L;N2 的的物质的量___mol
Ⅱ.某温度时,在一个2L的密闭容器中X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,据此回答:
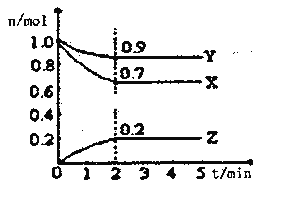
(1)该反应的化学方程式为___________
(2)从开始至2min,Z的平均反应速率为____________;
(3)改变下列条件,可以加快化学反应速率的有_________
A.升高温度 B.减小物质X的物质的量 C.减小压强 D.增加物质Z的物质的量. E.加入某种催化剂 F.缩小容积 G.使用效率更高的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向恒温恒容的密闭容器中充入H2(g)和I2(g)各0.1mol,发生反应H2(g)+I2(g)![]() 2HI(g),该反应的能量变化如图所示。下列说法正确的是( )
2HI(g),该反应的能量变化如图所示。下列说法正确的是( )
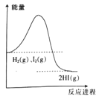
A. 该反应是吸热反应
B. 断裂0.05molH-H键和0.05molI-I键消耗的总能量小于生成0.1molH-I键释放的总能量
C. 当容器中气体密度不变时,说明反应已达到平衡状态
D. 达到平衡时,生成HI的分子数约为0.2×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1—溴丁烷的反应如下:
NaBr+H2SO4HBr+NaHSO4 ①
R—OH+HBr![]() R—Br+H2O ②
R—Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为Br2等。有关数据列表如下;
乙醇 | 溴乙烷 | 正丁醇 | 1—溴丁烷 | |
密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1—溴丁烷的制备实验中,下列仪器最不可能用到的是________。(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.长颈漏斗
(2)溴代烃的水溶性______(填“大于”、“等于”或“小于”)相应的醇,将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在______(填“上层”、“下层”或“不分层”)
(3)制备操作中,加入的浓硫酸必需进行稀释,其目的是____________。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是____________。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于______________ ;
但在制备1—溴丁烷时却不能边反应边蒸出产物,其原因是_______________________。
(6)得到的溴乙烷中含有少量乙醇,为了制得纯净的溴乙烷,可用蒸馏水洗涤,分液后,再加入无水CaCl2后进行的实验操作是______(填字母)
a.分液 b.蒸馏 c.萃取 d.过滤
(7)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后______(按实验的操作顺序选填下列序号)①加热 ②加入AgNO3 ③加入稀HNO3 ④加入NaOH溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用反应Cu+2FeCl3=CuCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是( )
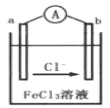
A. b为负极,发生还原反应
B. b电极反应式为2Fe3++2e-=Fe2+
C. 电子流动方向是a电极→FeCl3溶液→b电极
D. 电池的正极材料可以选用石墨、铂电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是 ( )
A. 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
B. 用铜作电极电解稀硫酸,反应Cu+H2SO4 ![]() CuSO4+H2↑可以发生
CuSO4+H2↑可以发生
C. 铅蓄电池放电时的负极和充电时的阳极均发生还原反应
D. 使用催化剂,可加快反应速率,改变反应限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 丙烷和丁烷互称为同系物
B. ![]() 的名称为3-甲基丁烷
的名称为3-甲基丁烷
C. 沸点:正丁烷>异丁烷>丙烷
D. CH3CH2CH2CH3和CH3CH(CH3)2互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),下列说法正确的是
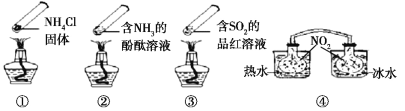
A. 加热时,①封管上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B. 加热时,②、③溶液均变红,冷却后又都变为无色
C. ④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D. 四个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com