
电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42—杂质,不符合电解要求,因此必须经过精制。某校实验小组精制粗盐水的实验过程如下:请回答以下问题:
(1)操作a的名称是 ,所用玻璃仪器有 、玻璃棒、烧杯;
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为(填化学式)
溶液;
(3)写出固体H所含物质的化学式 ;
(4)在Ⅴ步中,逐滴加入试剂丁直至溶液无明显变化时,写出此过程中发生反应的离子方程式: ; 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等物质组成。某同学为了鉴别它们,做了如下实验:
①将固体混合物溶于水,搅拌后得无色透明溶液;
②在①所得的溶液中滴加Ba(NO3)2溶液,有白色沉淀生成,并继续滴加至沉淀完全;
③过滤,然后在所得白色沉淀上加入过量稀硝酸,沉淀部分溶解。
根据该同学实验请你回答:
(1)原混合物中肯定有 ,肯定没有 ,可能含有 。
(2)写出上述实验过程中,可能发生反应的离子方程式:
。
(3)要检验可能含有的物质可采用的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
1mol某烃能与2molHCl完全加成,其产物最多能被6molCl2完全取代,则原烃可能为( )
A.乙炔 B.1,3-丁二烯 C.1-丙炔 D.1,3-环己二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
在无色透明的强酸性溶液中,下列离子组能大量共存的是 ( )
A.Na+、K+、OH—、Cl— B.Ba2+、Na+、CO32—、NO3—
C.Mg2+、Na+、SO42—、Cl— D.K+、NH4+、Cl—、Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
以NA代表阿伏加德罗常数,且已知C2H2(g)+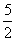 O2(g)===2CO2(g)+H2O(l) ΔH=-1 300 kJ/mol,则下列说法中正确的是( )
O2(g)===2CO2(g)+H2O(l) ΔH=-1 300 kJ/mol,则下列说法中正确的是( )
A.当有20NA个电子转移时,热化学方程式为2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2 600 kJ/mol
B.当有4NA个碳氧共有电子对生成时,放出1 300 kJ的能量
C.若生成NA个水蒸气分子的焓变为ΔH ′,则ΔH′<ΔH
D.题给反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,取0.2 mol·L-1 HX溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是( )
A.c(Na+)-c(X-)=9.9×10-7 mol·L-1
B.c(Na+)=c(X-)+c(HX)=0.2 mol·L-1
C.c(OH-)-c(HX)=c(H+)=1×10-6 mol·L-1
D.混合溶液中由水电离出的c(OH-)=10-8 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在pH都是9的NaOH和CH3COONa两种溶液中,设由水电离产生的c(OH-)分别为a mol·L-1与b mol·L-1,则a与b的关系为( )
A.a>b B.a=10-4b
C.b=10-4a D.a=b
查看答案和解析>>
科目:高中化学 来源: 题型:
T1、T2两种温度下BaSO4在水中的沉淀溶解平衡曲线如图所示,请回答下列问题:

(1)T1________T2(填“>”、“<”或“=”),T2时Ksp(BaSO4)=____________。
(2)根据T1温度时BaSO4的沉淀溶解平衡曲线,判断下列说法正确的是________(填序号)。
A.加入Na2SO4可由a点变为b点
B.在T1曲线上方区域(不含曲线)的任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能由d点变为T1曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
(3)沉淀的生成、溶解和转化在无机物制备和提纯及科研等领域有着广泛应用。已知25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
①医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是__________________(用沉淀溶解平衡原理解释)。万一误服了少量BaCl2,应尽快用大量0.5 mol/L Na2SO4溶液洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________mol/L。
②长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com