
T1、T2两种温度下BaSO4在水中的沉淀溶解平衡曲线如图所示,请回答下列问题:

(1)T1________T2(填“>”、“<”或“=”),T2时Ksp(BaSO4)=____________。
(2)根据T1温度时BaSO4的沉淀溶解平衡曲线,判断下列说法正确的是________(填序号)。
A.加入Na2SO4可由a点变为b点
B.在T1曲线上方区域(不含曲线)的任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能由d点变为T1曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
(3)沉淀的生成、溶解和转化在无机物制备和提纯及科研等领域有着广泛应用。已知25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
①医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是__________________(用沉淀溶解平衡原理解释)。万一误服了少量BaCl2,应尽快用大量0.5 mol/L Na2SO4溶液洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________mol/L。
②长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为__________________。
解析:(1)T1下的离子积较小,所以T1<T2。T2时的溶度积可利用c点的数据进行计算求得。(2)由于存在溶解平衡,加入Na2SO4,BaSO4的沉淀溶解平衡逆向移动,Ba2+的浓度降低,A选项正确;T1曲线上方区域的离子积大于溶度积,所以会析出沉淀,B选项正确;蒸发溶剂,不饱和溶液中离子的浓度都变大,可能由d点变为T1曲线上a、b之间的某一点,C选项正确;升高温度,c(SO )会变大,D选项错误。(3)①由沉淀溶解平衡BaSO4(s)Ba2+(aq)+SO
)会变大,D选项错误。(3)①由沉淀溶解平衡BaSO4(s)Ba2+(aq)+SO (aq)可知,H+不能减小Ba2+或SO
(aq)可知,H+不能减小Ba2+或SO 的浓度,平衡不能向溶解方向移动。由c(SO
的浓度,平衡不能向溶解方向移动。由c(SO )=0.5 mol/L和c(Ba2+)·c(SO
)=0.5 mol/L和c(Ba2+)·c(SO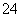 )=1×10-10可知c(Ba2+)=2×10-10 mol/L。②CaSO4转化为CaCO3的离子方程式为CaSO4(s)+CO
)=1×10-10可知c(Ba2+)=2×10-10 mol/L。②CaSO4转化为CaCO3的离子方程式为CaSO4(s)+CO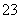 (aq)===CaCO3(s)+SO
(aq)===CaCO3(s)+SO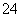 (aq)。
(aq)。
答案:(1)< 5.0×10-9 (2)ABC
(3)①对于沉淀溶解平衡BaSO4(s)Ba2+(aq)+SO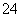 (aq),H+不能减小Ba2+或SO
(aq),H+不能减小Ba2+或SO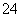 的浓度,平衡不能向溶解方向移动 2×10-10 ②CaSO4(s)+CO
的浓度,平衡不能向溶解方向移动 2×10-10 ②CaSO4(s)+CO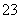 (aq)===CaCO3(s)+SO
(aq)===CaCO3(s)+SO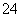 (aq)
(aq)


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42—杂质,不符合电解要求,因此必须经过精制。某校实验小组精制粗盐水的实验过程如下:请回答以下问题:
(1)操作a的名称是 ,所用玻璃仪器有 、玻璃棒、烧杯;
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为(填化学式)
溶液;
(3)写出固体H所含物质的化学式 ;
(4)在Ⅴ步中,逐滴加入试剂丁直至溶液无明显变化时,写出此过程中发生反应的离子方程式: ; 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1 mol/L的二元酸H2A溶液的pH=4.0,则下列说法中正确的是
( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有c(Na+)>c(A2-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.把a L 0.1 mol·L-1的CH3COOH溶液与b L 0.1 mol·L-1的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)=c(CH3COO-)+c(OH-)
B.把0.1 mol·L-1的NaHCO3溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba2+)>c(Na+)>c(H+)
C.向1 mol·L-1的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高
D.常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度、压强下的气体摩尔体积为55.20 L·mol-1,在该条件下有1 mol气体X发生如下反应并达到平衡:2X(g)mY(g)+Z(g),测得混合气体中X的体积分数为58.80%,混合气体的总质量为46.00 g,混合气体的密度为0.72 g·L-1。则平衡时混合气体的平均相对分子质量为( )
A.58.80 B.46.00
C.39.74 D.16.13
查看答案和解析>>
科目:高中化学 来源: 题型:
盐酸和K2CO3反应时,能使反应的最初速率明显加快的是( )
A.将盐酸用量增加一倍 B.盐酸的浓度增加一倍,用量减半
C.温度升高30 ℃ D.增加K2CO3粉末的量
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度和压强下,有1 mol某气体A,发生如下反应2A(g)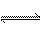 xB(g)+C(g),当达到平衡时,A在混合气中的体积分数为58.84%,混合气的总质量为46 g,平均相对分子质量为39.8,求:
xB(g)+C(g),当达到平衡时,A在混合气中的体积分数为58.84%,混合气的总质量为46 g,平均相对分子质量为39.8,求:
(1)A的分解率;
(2)x的值。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、________、________等玻璃仪器。
(2)步骤1过滤的目的是________。
(3)当步骤2中的溶液pH=8~9时,检验沉淀是否完全的方法是________。
(4)步骤2中溶液的pH控制较难操作,可改为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。

图Ⅰ
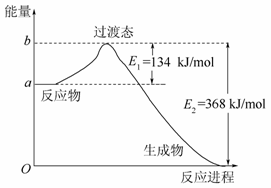
图Ⅱ
(1)图Ⅰ是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是__________(填“A”“B”或“C”);
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出了化学反应的过渡态理论:化学反应并不是简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:____________________________ _________________________________________________________;
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com