
已知0.1 mol/L的二元酸H2A溶液的pH=4.0,则下列说法中正确的是
( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有c(Na+)>c(A2-)>c(H+)>c(OH-)
【解析】 0.1 mol/L的一元强酸,pH=1,0.1 mol/L的二元强酸pH应小于1,二元酸H2A在浓度为0.1 mol/L时,pH=4,说明H2A为弱酸,Na2A水解有HA-生成,溶液中的离子有Na+、A2-、HA-、OH-、H+。而NaHA既能水解又能电离,溶液中的离子与前者相同,A项错。若Na2A与NaHA不水解且HA-不再电离,阴离子数目才相等,但由于水解反应A2-+H2OHA-+OH-,使阴离子增多,HA-+H2OH2A+OH-,阴离子不变,HA-H++A2-,阴离子不变,但A2-水解程度要大于HA-的电离程度,故前者阴离子数目多于后者,B选项也不正确。C选项符合电荷守恒关系,正确。D项Na2A溶液因A2-水解而显碱性,明显错误。
【答案】 C


科目:高中化学 来源: 题型:
1mol某烃能与2molHCl完全加成,其产物最多能被6molCl2完全取代,则原烃可能为( )
A.乙炔 B.1,3-丁二烯 C.1-丙炔 D.1,3-环己二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,取0.2 mol·L-1 HX溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是( )
A.c(Na+)-c(X-)=9.9×10-7 mol·L-1
B.c(Na+)=c(X-)+c(HX)=0.2 mol·L-1
C.c(OH-)-c(HX)=c(H+)=1×10-6 mol·L-1
D.混合溶液中由水电离出的c(OH-)=10-8 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在pH都是9的NaOH和CH3COONa两种溶液中,设由水电离产生的c(OH-)分别为a mol·L-1与b mol·L-1,则a与b的关系为( )
A.a>b B.a=10-4b
C.b=10-4a D.a=b
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是
( )
A.向饱和AgCl水溶液中加入盐酸,Ksp变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出
D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl溶解度大于AgI
查看答案和解析>>
科目:高中化学 来源: 题型:
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 化学方程 | 焓变ΔH/kJ·mol-1 | 活化能Ea/kJ·mol-1 | |
| 甲 烷 氧 化 | CH4(g)+2O2(g)=== CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=== CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸 汽 重 整 | CH4(g)+H2O(g)=== CO(g)+3H2(g) | +206.2 | 240.1 |
| CH4(g)+2H2O(g)=== CO2(g)+4H2(g) | +165.0 | 243.9 |
回答下列问题:
(1)反应CO(g)+H2O(g)===CO2(g)+H2(g)的ΔH=________kJ·mol-1。
(2)在初始阶段,甲烷蒸汽重整的反应速率________甲烷氧化的反应速率(填“大于”“小于”或“等于”)。
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp),则反应CH4(g)+H2O(g)CO(g)+3H2(g)的Kp=________,随着温度的升高,该平衡常数________(填“增大”“减小”或“不变”)。
(4)从能量角度分析,甲烷自热重整方法的先进之处在于
___________________________________________________________________。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
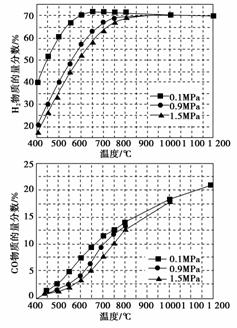
①若要达到H2物质的量分数>65%、CO物质的量分数<10%,以下条件中最合适的是________。
A.600 ℃,0.9 MPa B.700 ℃,0.9 MPa
C.800 ℃,1.5 MPa D.1 000 ℃,1.5 MPa
②画出600 ℃,0.1 MPa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:
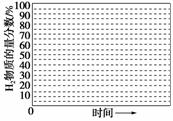
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是
___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行反应:X(g)+3Y(g)===2Z(g),有关下列图像的说法不正确的是( )
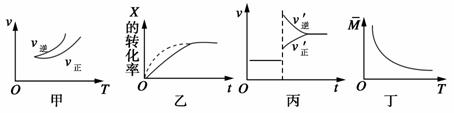
A.依据图甲可判断正反应为放热反应
B.在图乙中,虚线可表示使用了催化剂
C.若正反应的ΔH<0,图丙可表示升高温度使平衡向逆反应方向移动
D.由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
T1、T2两种温度下BaSO4在水中的沉淀溶解平衡曲线如图所示,请回答下列问题:

(1)T1________T2(填“>”、“<”或“=”),T2时Ksp(BaSO4)=____________。
(2)根据T1温度时BaSO4的沉淀溶解平衡曲线,判断下列说法正确的是________(填序号)。
A.加入Na2SO4可由a点变为b点
B.在T1曲线上方区域(不含曲线)的任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能由d点变为T1曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
(3)沉淀的生成、溶解和转化在无机物制备和提纯及科研等领域有着广泛应用。已知25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
①医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是__________________(用沉淀溶解平衡原理解释)。万一误服了少量BaCl2,应尽快用大量0.5 mol/L Na2SO4溶液洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________mol/L。
②长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
按照混合物、纯净物、强电解质、弱电解质、非电解质的顺序排列正确的一组是( )
A.盐酸、氯气、BaSO4、CO2、SO2
B.硫酸、氨水、醋酸、乙醇、NO2
C.漂白粉、胆矾、NH4Cl、CH3COOH、CO2
D.干冰、氯水、HCl、HClO、CO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com