
按照混合物、纯净物、强电解质、弱电解质、非电解质的顺序排列正确的一组是( )
A.盐酸、氯气、BaSO4、CO2、SO2
B.硫酸、氨水、醋酸、乙醇、NO2
C.漂白粉、胆矾、NH4Cl、CH3COOH、CO2
D.干冰、氯水、HCl、HClO、CO
科目:高中化学 来源: 题型:
已知0.1 mol/L的二元酸H2A溶液的pH=4.0,则下列说法中正确的是
( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有c(Na+)>c(A2-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度和压强下,有1 mol某气体A,发生如下反应2A(g)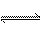 xB(g)+C(g),当达到平衡时,A在混合气中的体积分数为58.84%,混合气的总质量为46 g,平均相对分子质量为39.8,求:
xB(g)+C(g),当达到平衡时,A在混合气中的体积分数为58.84%,混合气的总质量为46 g,平均相对分子质量为39.8,求:
(1)A的分解率;
(2)x的值。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、________、________等玻璃仪器。
(2)步骤1过滤的目的是________。
(3)当步骤2中的溶液pH=8~9时,检验沉淀是否完全的方法是________。
(4)步骤2中溶液的pH控制较难操作,可改为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
容积的相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g)2SO3(g),并达到平衡状态。在这个过程中,甲容器保持压强不变,乙容器保持容积不变。若甲容器中SO2的平衡转化率为P%,则乙容器中SO2的平衡转化率( )
A.等于P% B.大于P%
C.小于P% D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1 L的密闭容器中,进行如下反应:A(g)+2B(g)C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
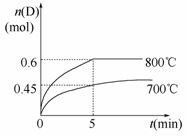
请回答下列问题:
(1)700℃时,0~5min内,以B表示的平均反应速率为_______。
(2)能判断反应达到化学平衡状态的依据是__________。
A.容器中压强不变
B.混合气体中c(A)不变
C.v正(B)=2v逆(D)
D.c(A)=c(C)
(3)若最初加入1.0 mol A和2.2 mol B,利用图中数据计算800℃时的平衡常数K=__________,该反应为__________反应(填“吸热”或“放热”)。
(4)800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,则此时该反应__________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图拴上金属条的铁钉插在含有酚酞的NaCl溶液中,可以看到贴近金属条一边的溶液出现粉红色,该金属条可能是( )
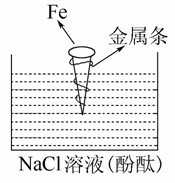
A.Cu B.Al
C.Zn D.Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。

图Ⅰ
图Ⅱ
(1)图Ⅰ是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是__________(填“A”“B”或“C”);
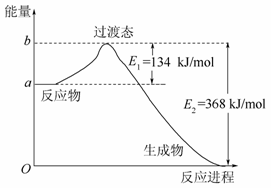
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出了化学反应的过渡态理论:化学反应并不是简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:____________________________ _________________________________________________________;
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图。
查看答案和解析>>
科目:高中化学 来源: 题型:
己二酸是一种重要的有机二元 酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备。反应原理:
酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备。反应原理:
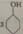 +8HNO3
+8HNO3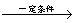 3HOOC(CH2)4COOH+8NO
3HOOC(CH2)4COOH+8NO +7H2O,反应装置(部分夹持装置和热源已省略)如图所示。
+7H2O,反应装置(部分夹持装置和热源已省略)如图所示。
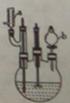
实验步骤:
I.在60mL三颈烧瓶中加入16.0mL50%硝酸(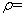 1.31g·cm-1)和微量(0.01g)偏钒酸铵,瓶的正口安装电动搅拌器,两侧口分别安装仪器a和b。用仪器b滴加5.3mL环己醇,搅拌器用玻璃搅拌棒,仪器a另一端连接气体吸收装置,用纯碱液作吸收溶液。
1.31g·cm-1)和微量(0.01g)偏钒酸铵,瓶的正口安装电动搅拌器,两侧口分别安装仪器a和b。用仪器b滴加5.3mL环己醇,搅拌器用玻璃搅拌棒,仪器a另一端连接气体吸收装置,用纯碱液作吸收溶液。
II.首先将瓶内液体加热到50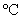 左右,开动搅拌器,滴入环己醇(
左右,开动搅拌器,滴入环己醇(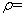 0.9624g·cm-1),使反应处于微沸状态,滴加完毕后于90
0.9624g·cm-1),使反应处于微沸状态,滴加完毕后于90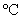 左右水浴加热20分钟,至反应完毕。
左右水浴加热20分钟,至反应完毕。
III.趁热倒出瓶中混合液于烧杯内,烧杯置于冰水浴中,静置冷却,析出产品,过滤,用少量冷水洗涤沉淀,干燥后称重。
IV.将粗产品在水中进行重结晶操作。
请回答下列问题:
(1)仪器a的名称是_________________。仪器b在使用前应_________________。
(2)偏钒酸铵的作用是_______________。
(3)反应完成后,趁热倒出反应液的目的是___ ________________
________________ 。
。
(4)本实验中己二酸的理论产量为______________g。
(5)用纯碱液吸收尾气时发生的相关化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2 ①
NO+NO2+Na2CO3=2NaNO2+NaNO3+CO2 ②
现用1000g质量分数为21.2%的纯碱吸收液吸收尾气,每产生22.4L(标准状况下)CO2 时,吸收液 质量就增加44g,则吸收液中NaNO2和NaNO3的物质的量之比为_________。
质量就增加44g,则吸收液中NaNO2和NaNO3的物质的量之比为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com