
【题目】实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾[KAl(SO4)2·12H2O]的过程如图所示。下列说法正确的是
![]()
A. 试剂①可选用盐酸或NaOH溶液
B. 过滤操作中使用的玻璃仪器只有漏斗、烧杯
C. 滤液A到沉淀B的反应中无CO2生成
D. 最后一步操作是蒸发结晶
科目:高中化学 来源: 题型:
【题目】已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是 ( )
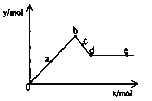
A. a—b时沉淀的物质的量:A1(OH)3比BaSO4多
B. c—d时溶液中离子的物质的量:AlO2–比Ba2+多
C. a—d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D. d—e时溶液中离子的物质的量:Ba2+不能等于OH–
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素的原子半径的相对大小、最高正价或最低负价的变化如下图所示,下列分析正确的是( )
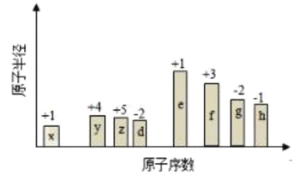
A.![]() 、
、![]() 的简单离子半径大小:
的简单离子半径大小:![]()
B.元素的金属性:![]()
C.元素的非金属性:![]()
D.![]() 、
、![]() 、
、![]() 和
和![]() 四种元素能形成离子化合物
四种元素能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表
2NO2(g)体系中,n(NO)随时间的变化如表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。
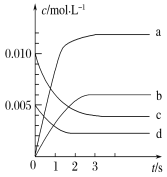
(2)能说明该反应已达到平衡状态的是________(填字母,下同)。
a. v(NO2)、v(O2)、v(NO)相等
b. 容器内各物质浓度保持不变
c. 该反应v逆=v正
d. 容器内总质量保持不变
(3)为使该反应的反应速率增大,下列措施正确的是________。
a 及时分离出NO2气体 b 适当升高温度
c 增大O2的浓度 d 选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取自来水的装置示意图,根据图示回答下列问题。

(1)图中的两处明显的错误是____________________、_____________________。
(2)A仪器的名称是______________,B仪器的名称是_______________。
(3)实验时A中除加入少量自来水外,还需加入少量___________,其作用是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2RCH2CHO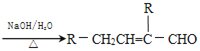 ,水杨酸酯E为紫外吸收剂,可用于配制防晒霜。E的一种合成路线如下:
,水杨酸酯E为紫外吸收剂,可用于配制防晒霜。E的一种合成路线如下:
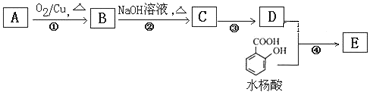
已知D的相对分子质量是130。请回答下列问题:
(1)一元醇A中氧的质量分数约为21.6%,则A的分子式为______, 结构分析显示A只有一个甲基,A的名称为______;
(2)第④步的反应条件为______;写出E的结构简式______:
(3)B能与新制的Cu(OH)2发生反应,该反应的化学方程式为:______;
(4)写出同时符合下列条件水杨酸的同分异构体的结构简式:______
(a)能与FeCl3发生显色反应;
(b)能与银氨溶液反应
(c)能发生水解反应
(d)核磁共振氢谱显示有四组峰。且峰面积比为1:2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把在空气中久置的铝片5.0g投入盛有50mL 0.1molL-1盐酸溶液的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系,可用如图所示的坐标曲线来表示,下列推论错误的是( )
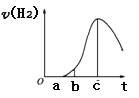
A.O→a段不产生氢气是因为表面的氧化物隔离了铝和稀盐酸
B.a→b段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时刻,反应处于平衡状态
D.t>c,产生氢气的速率降低的主要原因是溶液中H+浓度下降
查看答案和解析>>
科目:高中化学 来源: 题型:
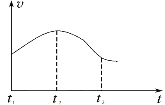
【题目】Ⅰ.一定温度下,在容积为V L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:

(1)此反应的化学方程式中a/b=___________;
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为_________________;
(3) N的平衡转化率为_______________;
(4)下列叙述中能说明上述反应达到平衡状态的是___________(填字母)。
a.反应中M与N的物质的量之比为1︰1
b.混合气体的总质量不随时间的变化而变化
c.混合气体的总物质的量不随时间的变化而变化
d.单位时间内每消耗a mol N,同时生成b mol M
e.混合气体的压强不随时间的变化而变化
f.N的质量分数在混合气体中保持不变
Ⅱ.研究性学习小组为探究铁与稀盐酸反应,取同质量、体积的铁片、同浓度的盐酸做了下列平行实验:
实验①:把纯铁片投入到盛有稀盐酸的试管中,发现放出氢气的速率变化如图所示:
实验②:把铁片投入到含FeCl3的同浓度稀盐酸中,发现放出氢气的量减少。
实验③:在稀盐酸中滴入几滴CuCl2溶液,用铁片做实验,发现生成氢气的速率加快。
试回答下列问题:
(1)分析实验①中t1~t2速率变化的主要原因是_______,t2~t3速率变化的主要原因是______。
(2)实验②放出氢气的量减少的原因是___________________(用离子方程式表示)。
(3)某同学认为实验③反应速率加快的主要原因是形成了原电池,你认为是否正确?请选择下列相应的a或b作答。a.若不正确,请说明原因_____________________________________。b.若正确,则写出实验③中原电池的正极电极反应式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】D是一种催眠药,F是一种香料,它们的合成路线如下:
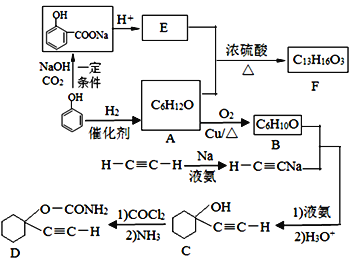
(1)A的化学名称是___,C中含氧官能团的名称为_____。
(2)F的结构简式为____,A和E生成F的反应类型为____。
(3)A生成B的化学方程式为________。
(4)写出由C合成D的第二个反应的化学方程式:________。
(5)同时满足下列条件的E的同分异构体有___种(不含立体异构)。
①遇FeCl3溶液发生显色反应;
②能发生银镜反应
(6)以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_____。
(7)
乙炔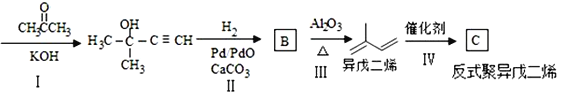
①写出C的结构简式:___
②写出从I至IV的反应类型分别为:_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com