
(共6分)实验室制取SO2的反应原理之一为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:( ×100℅)
×100℅)
(1)这些装置的连接顺序(按气体左右的方向)是 → → → → → → → → (填各接口的编号)。
(2)实验时甲橡胶管的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
(共6分)实验室制取SO2的反应原理之一为: Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:(![]() ×100℅)
×100℅)
(1)这些装置的连接顺序(按气体左右的方向)是 → → → → → → → → (填各接口的编号)。
(2)实验时甲橡胶管的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省临汾一中高一6月月考化学试卷(带解析) 题型:填空题
(1)下面各个小题已经给出了化学反应的反应物,试写出完整的化学反应方程式并配平:(每小题2分,共6分)
过量乙酸与甘油的酯化反应
蔗糖水解:
CH3CH(OH)CH3的催化氧化:
(2)(4分).硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HI Ⅱ.2HI H2+I2 Ⅲ.2H2SO4===2SO2+O2+2H2O
H2+I2 Ⅲ.2H2SO4===2SO2+O2+2H2O
(1)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,生成的I2为气体,H2物质的量随时间的变化如图所示。0-2 min内的平均反应速率υ(HI)= 
(2)实验室用Zn和硫酸制取H2,为了加快反应速率,下列措施不可行的是 (填序号)
a.加入浓硝酸 b.加入少量CuSO4固体 c.用粗锌代替纯锌
d.加热 e.把锌粒弄成锌粉 f.用98.3%浓硫酸
查看答案和解析>>
科目:高中化学 来源:2014届山西省高一6月月考化学试卷(解析版) 题型:填空题
(1)下面各个小题已经给出了化学反应的反应物,试写出完整的化学反应方程式并配平:(每小题2分,共6分)
过量乙酸与甘油的酯化反应
蔗糖水解:
CH3CH(OH)CH3的催化氧化:
(2)(4分).硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HI
Ⅱ.2HI H2+I2 Ⅲ.2H2SO4===2SO2+O2+2H2O
H2+I2 Ⅲ.2H2SO4===2SO2+O2+2H2O
(1)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,生成的I2为气体,H2物质的量随时间的变化如图所示。 0-2 min内的平均反应速率υ(HI)=

(2)实验室用Zn和硫酸制取H2,为了加快反应速率,下列措施不可行的是 (填序号)
a.加入浓硝酸 b.加入少量CuSO4 固体 c.用粗锌代替纯锌
d.加热 e.把锌粒弄成锌粉 f.用98.3%浓硫酸
查看答案和解析>>
科目:高中化学 来源:2014届山西省高一2月月考化学试卷 题型:实验题
(共6分)实验室制取SO2的反应原理之一为: Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:(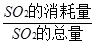 ×100℅)
×100℅)
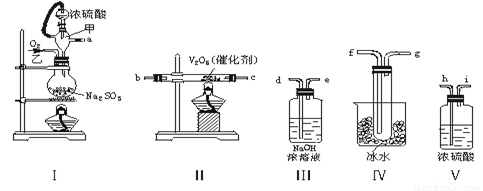
(1)这些装置的连接顺序(按气体左右的方向)是 → → → → → → → → (填各接口的编号)。
(2)实验时甲橡胶管的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com