
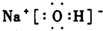 ,
,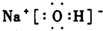 ;
;

科目:高中化学 来源: 题型:
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、①④ | C、①③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
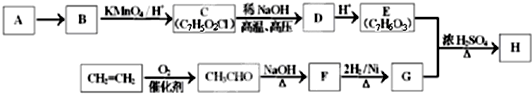
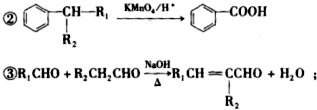 (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
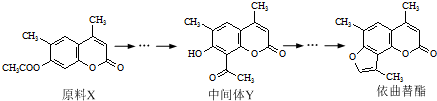
| A、原料X酸性条件下水解产物与中间体Y互为同分异构体 |
| B、原料X不能使酸性KMnO4溶液褪色 |
| C、中间体Y能发生加成、取代、氧化等反应 |
| D、1 mol依曲替酯只能与1 mol NaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com