
ЁОЬтФПЁП2018 Фъ 11дТЃЌЙњМЪМЦСПДѓЛсЕк 26 ДЮЛсвщНЋАЂЗќМгЕТТоГЃЪ§ЕФЖЈвхаоИФЮЊЁА1ФІЖћАќКЌ6.02214076ЁС1023ИіЛљБОЕЅдЊЃЌЕЅЮЛЮЊ mol-1ЁЃЛљгкетвЛаТЖЈвхЃЌАЂЗќМгЕТТоГЃЪ§ЕФВЛШЗЖЈЖШБЛЯћГ§СЫЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
A.10gЕФ1H218OКЌгаЕФжЪзгЪ§гыжазгЪ§ОљЮЊ5ЁС6.02214076ЁС1023
B.100gNaHSO4КЭ20g KHSO3ЕФЙЬЬхЛьКЯЮяжабєРызгЪ§ЮЊ2ЁС6.02214076ЁС1023
C.БъзМзДПіЯТЃЌ2.24L Cl2ШмгкЫЎЃЌзЊвЦЕчзгЪ§ФПЮЊ6.02214076ЁС1022
D.12gН№ИеЪЏжаКЌгаЛЏбЇМќЕФЪ§ФПЮЊ4ЁС6.02214076ЁС1023
ЁОД№АИЁПA
ЁОНтЮіЁП
A.10gЕФ1H218OЮяжЪЕФСПЃН![]() ЃН0.5molЃЌЗжзгжажЪзгЪ§ЃН10ЃЌжазгЪ§ЃН10ЃЌКЌгаЕФжЪзгЪ§гыжазгЪ§ОљЮЊ5ЁС6.02214076ЁС1023ЃЌЙЪAе§ШЗЃЛ
ЃН0.5molЃЌЗжзгжажЪзгЪ§ЃН10ЃЌжазгЪ§ЃН10ЃЌКЌгаЕФжЪзгЪ§гыжазгЪ§ОљЮЊ5ЁС6.02214076ЁС1023ЃЌЙЪAе§ШЗЃЛ
B.100gNaHSO4ЮяжЪЕФСПЃН![]() ЃН1molЃЌКЌбєРызг1ЁС6.02214076ЁС1023ЃЌ20g KHSO3ЕФЙЬЬхЮяжЪЕФСПЃН
ЃН1molЃЌКЌбєРызг1ЁС6.02214076ЁС1023ЃЌ20g KHSO3ЕФЙЬЬхЮяжЪЕФСПЃН![]() ЃН
ЃН![]() molЃЌЛьКЯЮяжабєРызгЪ§ЮЊ
molЃЌЛьКЯЮяжабєРызгЪ§ЮЊ![]() ЁС6.02214076ЁС1023ЃЌЙЪBДэЮѓЃЛ
ЁС6.02214076ЁС1023ЃЌЙЪBДэЮѓЃЛ
CЃЎБъПіЯТ2.24LТШЦјЕФЮяжЪЕФСПЃН![]() ЃН0.1molЃЌ0.1molТШЦјШмгкЫЎЃЌжЛгаЩйСПТШЦјгыЫЎЗДгІЩњГЩТШЛЏЧтКЭДЮТШЫсЃЌЫљвдзЊвЦЕФЕчзгаЁгк0.1molЃЌзЊвЦЕФЕчзгЪ§ФПаЁгк0.1NAЃЌЙЪCДэЮѓЃЛ
ЃН0.1molЃЌ0.1molТШЦјШмгкЫЎЃЌжЛгаЩйСПТШЦјгыЫЎЗДгІЩњГЩТШЛЏЧтКЭДЮТШЫсЃЌЫљвдзЊвЦЕФЕчзгаЁгк0.1molЃЌзЊвЦЕФЕчзгЪ§ФПаЁгк0.1NAЃЌЙЪCДэЮѓЃЛ
DЃЎдкН№ИеЪЏжаЃЌ1ИіCдзгВЮгыаЮГЩ4ИіCЉCМќЃЌдђ1ИіCдзгаЮГЩ4ЁС![]() ЃН2ИіCЉCМќЃЌn(Н№ИеЪЏ)ЃН
ЃН2ИіCЉCМќЃЌn(Н№ИеЪЏ)ЃН![]() ЃН1molЃЌЫљвд12gН№ИеЪЏжаКЌга2ЁС6.02214076ЁС1023ИіЛЏбЇМќЃЌЙЪDДэЮѓЃЛ
ЃН1molЃЌЫљвд12gН№ИеЪЏжаКЌга2ЁС6.02214076ЁС1023ИіЛЏбЇМќЃЌЙЪDДэЮѓЃЛ
ЙЪД№АИЮЊAЁЃ


 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвгУШчЭМЫљЪОзАжУЃЈЭМжаМаГжвЧЦїТдШЅЃЉВтЖЈбРИрбљЦЗжаЬМЫсИЦЕФжЪСПЗжЪ§ЃЌЯТСаЫЕЗЈДэЮѓЕФЪЧ
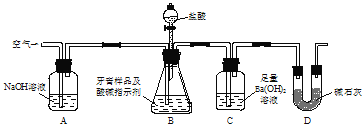
A.ЪЕбщЙ§ГЬжаГжајЭЈШыПеЦјПЩЦ№ЕННСАшBЁЂCжаЕФЗДгІЮяЕФзїгУ
B.ЪЕбщЙ§ГЬжаЕЮМгбЮЫсЕФЫйТЪВЛвЫЙ§Пь
C.вРОнзАжУCдкЗДгІЧАКѓЕФжЪСПВюВтЖЈЕФНсЙћЛсЦЋИп
D.CжаЕФГСЕэОЙ§ТЫЁЂИЩдяЁЂГЦжиКѓПЩШЗЖЈбРИрбљЦЗжаЬМЫсИЦЕФжЪСП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉТШЛЏЬњЫЎНтЕФРызгЗНГЬЪНЮЊ_________________________________ЃЌЪЕбщЪвХфжЦТШЛЏЬњШмвКЪБЃЌГЃНЋТШЛЏЬњЯШШмгкХЈбЮЫсЃЌШЛКѓдйМгЫЎЯЁЪЭЃЌЦфФПЕФЪЧ_________________________ЁЃ
ЃЈ2ЃЉШєЯђТШЛЏЬњШмвКжаМгШыЬМЫсИЦЗлФЉЃЌЬМЫсИЦж№НЅж№НЅШмНтЃЌВЂВњЩњЮоЩЋЦјЬхЕФРызгЗНГЬЪНЮЊ________ЃЌШмвКжаЭЌЪБгаКьКжЩЋГСЕэЩњГЩЃЌЦфдвђЪЧ______________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГ§ШЅЯТСаЮяжЪжаЫљКЌдгжЪ(РЈКХжаЕФЮяжЪ)ЫљбЁгУЕФЪдМСКЭзАжУОље§ШЗЕФЪЧ (ЁЁЁЁ )
ЂёЃЎЪдМС:ЂйKMnO4/HЃЋЂкNaOHШмвК ЂлБЅКЭNa2CO3ШмвКЂмH2O ЂнNa ЂоBr2/H2O ЂпBr2/CCl4
ЂђЃЎзАжУЃК

бЁЯю | ЮяжЪ | ЪдМС | зАжУ |
A | C2H6(C2H4) | Ђо | Ђй |
B | БН(БНЗг) | Ђй | Ђл |
C | CH3COOC2H5(CH3COOH) | Ђл | Ђк |
D | МзБН(ЖўМзБН) | Ђй | Ђл |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЬѕМўЯТЃЌЖдгкКуШнУмБеШнЦїжаНјааЕФПЩФцЗДгІ2NO2(g)![]() 2NO(g)+O2(g)ЃЌЯТСаЫЕЗЈжаФмЫЕУїЗДгІвЛЖЈвбОДяЕНЛЏбЇЦНКтзДЬЌЕФЪЧЃЈ ЃЉ
2NO(g)+O2(g)ЃЌЯТСаЫЕЗЈжаФмЫЕУїЗДгІвЛЖЈвбОДяЕНЛЏбЇЦНКтзДЬЌЕФЪЧЃЈ ЃЉ
ЂйЕЅЮЛЪБМфЩњГЩn mol O2ЕФЭЌЪБЩњГЩ2n mol NO2ЃЛ
Ђк2vе§(NO2)=vФц(O2)
ЂлNO2ЁЂNOЁЂO2ЕФЮяжЪЕФСПХЈЖШжЎБШЮЊ2ЃК2ЃК1ЃЛ
ЂмШнЦїФкбЙЧПВЛдйИФБф
ЂнУмБеШнЦїжаЛьКЯЦјЬхЕФУмЖШВЛдйИФБфЃЛ
ЂоЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПВЛдйИФБф
A.ЂйЂмЂоB.ЂкЂлЂнC.ЂйЂкЂоD.ЂйЂлЂн
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКЃбѓЪЧОоДѓЕФзЪдДБІПтЃЌДгЦфжаЬсШЁЪГбЮКЭфхЕФЙ§ГЬШчЭМЫљЪОЁЃЯТСаУшЪіДэЮѓЕФЪЧЃЈ ЃЉ
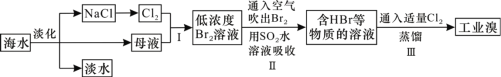
A.ЕЛЏКЃЫЎЕФЗНЗЈжївЊгаеєСѓЗЈЁЂЕчЩјЮіЗЈЁЂРызгНЛЛЛЗЈ
B.вдNaClЮЊдСЯПЩвдЩњВњЩеМюЁЂДПМюЁЂН№ЪєФЦЁЂТШЦјЁЂбЮЫсЕШЛЏЙЄВњЦЗ
C.SO2ЫЎШмвКЮќЪеBr2ЕФРызгЗДгІЗНГЬЪНЮЊBr2ЃЋSO2ЃЋ2H2O=4H+ЃЋSO42-ЃЋ2Br-
D.ВНжшЂђжаЙФШыШШПеЦјДЕГіфхЃЌЪЧвђЮЊфхеєЦјЕФУмЖШБШПеЦјЕФУмЖШаЁ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдЊЫижмЦкБэЪЧНјааЛЏбЇбаОПЕФживЊЙЄОпЃЌШчЭМЪЧдЊЫижмЦкБэЕФвЛВПЗжЃЌЦфжаЂйЁЋЂсДњБэ9жждЊЫиЁЃЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЩЯЪідЊЫижазюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяЕФЫсадзюЧПЕФЪЧ___ЃЈЬюЮяжЪЕФЛЏбЇЪНЃЉЁЃ
ЃЈ2ЃЉЩЯЪідЊЫижазюЮШЖЈЕФМђЕЅЧтЛЏЮяЪЧ___ЃЈЬюЮяжЪЕФЛЏбЇЪНЃЉЃЌЧыгУЕчзгЪНБэЪОЦфаЮГЩЙ§ГЬЃК___ЃЛЂкЂмЂоаЮГЩЕФ1ЃК1ЃК1аЭЛЏКЯЮяЕФЕчзгЪНЮЊ___ЁЃ
ЃЈ3ЃЉЯТСаЭЦЖЯе§ШЗЕФЪЧ___ЃЈЬюбЁЯюзжФИЃЉЁЃ
A.ЂсЕФЕЅжЪПЩФмЮЊАзЩЋЙЬЬх
B.ЂрЕФЕЅжЪФмгыЫЎОчСвЗДгІЩњГЩЧтЦј
C.ЂйЁЂЂоЕФМђЕЅЧтЛЏЮяжЎМфЗДгІЕФВњЮяжаМШКЌРызгМќгжКЌМЋадМќ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪвЮТЯТЃЌНЋвЛдЊЫс HA ЕФШмвККЭ KOH ШмвКЕШЬхЛ§ЛьКЯ(КіТдЬхЛ§БфЛЏ)ЃЌЪЕбщЪ§ОнШчЯТБэЃК

ЯТСаХаЖЯВЛе§ШЗЕФЪЧ( )
A.ЪЕбщЂйЗДгІКѓЕФШмвКжаЃКc(K+)>c(AЃ)>c(OHЃ)>c(H+)
B.ЪЕбщЂйЗДгІКѓЕФШмвКжаЃКc(OHЃ)ЃНc(K+)Ѓc(AЃ)ЃНKW/1ЁС10-9mol/L
C.ЪЕбщЂкЗДгІКѓЕФШмвКжаЃКc(AЃ)+c(HA)>0.1 mol/L
D.ЪЕбщЂкЗДгІКѓЕФШмвКжаЃКc(K+)ЃНc(AЃ)>c(OHЃ)ЃНc(H+)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПMnSO4ОЇЬхЪЧвЛжжвзШмгкЫЎЕФЮЂКьЩЋОЇЬхЃЌФГаЃЭЌбЇЩшМЦЪЕбщжЦБИВЂМьбщMnSO4ЕФаджЪЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉМззщЭЌбЇЩшМЦгУSO2КЭЪЪСПДПОЛЕФMnO2жЦБИMnSO4ЃЌЦфзАжУШчЯТЃК
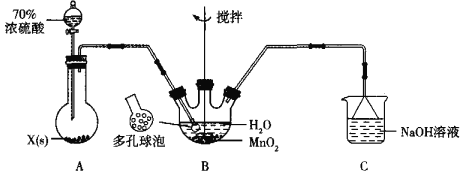
ЂйAзАжУжаЙЬЬхвЉЦЗXЭЈГЃЪЧ______ЬюЛЏбЇЪНЃЉЁЃ
ЂкBзАжУжаЭЈSO2ЕФЕМЙмФЉЖЫНгЖрПзЧђХнЕФФПЕФЪЧ______ЃЛCзАжУгУгкЮќЪеЩйСПЕФSO2ЃЌЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ______ЁЃ
ЃЈ2ЃЉввзщЭЌбЇЖЈадМьбщМззщЭЌбЇЕФВњЦЗжаMn2+ЕФДцдкЃЌШЁЩйСПОЇЬхШмгкЫЎЃЌМгШыЃЈNH4ЃЉ2S2O8ШмвКЃЌЕЮШыЯѕЫсвјЃЈзїДпЛЏМСЃЉЃЌЮЂШШеёЕДЃЌШмвКЯдзЯЩЋЃЌЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ______ЁЃ
ЃЈ3ЃЉБћзщЭЌбЇЮЊМьбщЮоЫЎMnSO4ЃЈНгНќАзЩЋЃЉЕФШШЗжНтВњЮяЃЌНЋMnSO4ОЇЬхЭбЫЎКѓЗХШыЯТЭМЫљЪОЕФзАжУжаЃЌДђПЊK1КЭK2ЃЌЛКТ§ЭЈШыN2ЃЌМгШШЃЌгВжЪВЃСЇЙмжазюКѓЕУЕНКкЩЋЙЬЬхЁЃ
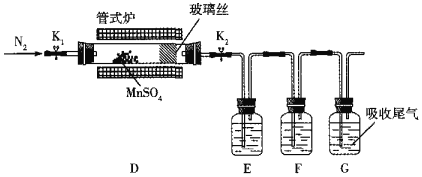
ЂйМьбщЗжНтЕФЦјЬЌВњЮяжаЪЧЗёгаSO2МАSO3ЃЌзАжУEЁЂFжаЕФШмвКвРДЮЪЧ______ЁЂ______ЃЈЬюзжФИЃЉЁЃ
aЃЎBaЃЈNO3ЃЉ2ШмвКbЃЎBaCl2ШмвКcЃЎЦЗКьШмвКdЃЎХЈСђЫс
ЂкШєDжаЕУЕНЕФКкЩЋЗлФЉЮЊMn3O4ЃЌEЁЂFжаОљгаУїЯдЯжЯѓЃЌдђDжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ______ЁЃ
ЃЈ4ЃЉЖЁзщЭЌбЇЩшМЦЪЕбщвдБћзщЭЌбЇЕУЕНЕФКкЩЋЗлФЉЮЊдСЯЃЌРћгУТСШШЗДгІдРэНЋЦфЛЙдЮЊН№ЪєУЬЃЌЫљашЕФвЉЦЗГ§ТШЫсМиЭтЃЌЛЙашвЊ______ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com