
 一定温度下2升的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应:C(s)+CO2(g)?2CO(g)△H>0,测得容器中CO2的物质的量随时间t的变化关系如图所示.
一定温度下2升的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应:C(s)+CO2(g)?2CO(g)△H>0,测得容器中CO2的物质的量随时间t的变化关系如图所示.| c2(CO) |
| c(CO2) |
| 0.76mol/L |
| 2L |
| 2.48mol/L |
| 2L |
| c2(CO) |
| c(CO2) |
| 1.242 |
| 0.38 |
| c2(CO) |
| c(CO2) |
| 22 |
| 2 |


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
| A、将盐酸用量增加一倍 |
| B、盐酸的浓度增加一倍,用量减半 |
| C、温度升高30℃ |
| D、增加K2CO3粉末的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
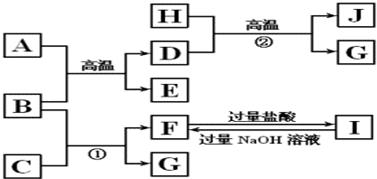
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素符号 | Li | Be | B | C | O | F |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
| 元素符号 | Na | Al | Si | P | S | Cl |
| x值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 标准状况V(CO2)/L | 所得固体组成(填化学式) | 所得固体质量m/g |
查看答案和解析>>
科目:高中化学 来源: 题型:
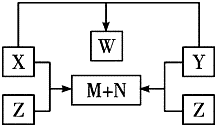
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com