
| x+0.5y |
| x+y |
| 7 |
| 9 |


科目:高中化学 来源: 题型:
| 8 |
| 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
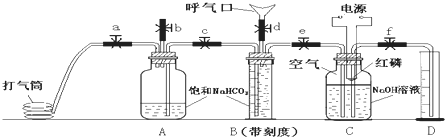
查看答案和解析>>
科目:高中化学 来源: 题型:
按体积比为1∶2∶3组成的N2、O2、CO2的混合气体100 g在标准状况下的体积为( )
A.60 L B.30 L C.11.2 L D.112 L
查看答案和解析>>
科目:高中化学 来源:2015届山东省济宁市高一1月考前模拟化学试卷(解析版) 题型:选择题
等物质的量的N2,O2,CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压)这时混合气体中N2,O2,CO2的物质的量之比为( )
A.3:4:1 B.3:3:2 C.6:7:3 D.6:9:0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com