
| A、向氢氧化钾溶液中滴加少量氯化铝溶液 Al3++4OH-=AlO2-+2H2O |
| B、在亚硫酸中加入过量的次氯酸钠溶液 H2SO3+3ClO-=Cl-+2HClO+SO42- |
| C、在稀HNO3溶液加入FeS固体 FeS+2H+=Fe2++H2S↑ |
| D、在过氧化钠中加入稀硫酸 2Na2O2+4H+=4Na++2H2O+O2↑ |


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
| A、I->Fe2+>Cl->SO2 |
| B、Cl->Fe2+>SO2>I- |
| C、Fe2+>I->Cl->SO2 |
| D、SO2>I->Fe2+>Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 1mol/L MgCl2溶液 |
| B、200mL 0.25mol/L AlCl3溶液 |
| C、200ml 1mol/L NaCl溶液 |
| D、200ml 0.5mol/L HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7m之间 |
| B、胶体分散质的直径介于溶液和浊液分散质直径之间 |
| C、用激光笔照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
| D、Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl+NaOH═NaCl+NH3?H2O |
| B、Mg(OH)2+2HCl═MgCl2+2H2O |
| C、NaOH+NaHCO3═Na2CO3+H2O |
| D、NaOH+HNO3═NaNO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2的摩尔质量是16g |
| B、碱性氧化物一定是金属氧化物,酸性氧化物一定是非金属氧化物 |
| C、碳酸钠溶液能使酚酞试液变红,因此它是碱 |
| D、虽然二氧化碳溶于水能导电,但它是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度相等的Na2S和NaHS混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| B、常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C、常温下c(NH4+)相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中,溶质的物质的量浓度大小:①>②>③ |
| D、等体积、等物质的量浓度的NaX和弱酸HX混合后呈酸性的溶液中:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
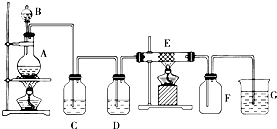 如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.
如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.查看答案和解析>>
科目:高中化学 来源: 题型:
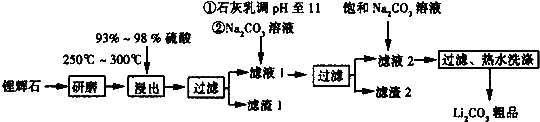
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
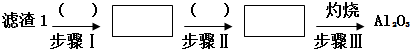
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com