
| A、NH4Cl+NaOH═NaCl+NH3?H2O |
| B、Mg(OH)2+2HCl═MgCl2+2H2O |
| C、NaOH+NaHCO3═Na2CO3+H2O |
| D、NaOH+HNO3═NaNO3+H2O |


科目:高中化学 来源: 题型:
 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路(未闭合K)后发现
为电镀槽.接通电路(未闭合K)后发现 上的c点显红色.为实现铁上镀铜,使c、d两点短路.下列叙述不正确的是( )
上的c点显红色.为实现铁上镀铜,使c、d两点短路.下列叙述不正确的是( ) 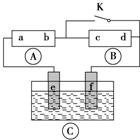
| A、b为直流电源的负极 |
| B、f极为阴极,发生还原反应 |
| C、e极材料为铁片,f极材料的铜片 |
| D、可选用CuSO4溶液或CuCl2溶液作电镀液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向氢氧化钾溶液中滴加少量氯化铝溶液 Al3++4OH-=AlO2-+2H2O |
| B、在亚硫酸中加入过量的次氯酸钠溶液 H2SO3+3ClO-=Cl-+2HClO+SO42- |
| C、在稀HNO3溶液加入FeS固体 FeS+2H+=Fe2++H2S↑ |
| D、在过氧化钠中加入稀硫酸 2Na2O2+4H+=4Na++2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、①③ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度 (mol?L-1) | 0.00l0 | 0.0100 | 0.0200 | 0.1000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:
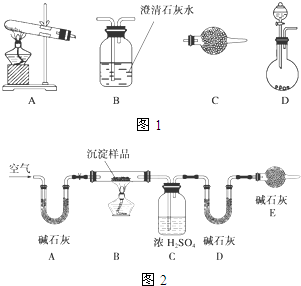 某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.甲同学认为两者反应只生成CuCO3一种沉淀;乙同学认为这两者相互促进水解,只生成Cu(OH)2一种沉淀;丙同学认为生成CuCO3和Cu(OH)2两种沉淀.(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.甲同学认为两者反应只生成CuCO3一种沉淀;乙同学认为这两者相互促进水解,只生成Cu(OH)2一种沉淀;丙同学认为生成CuCO3和Cu(OH)2两种沉淀.(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com