
| m |
| M |
| N |
| NA |
| m |
| M |
| 1g |
| 2g/mol |
| m |
| M |
| N |
| NA |
| m |
| 64g/mol |
| m |
| 80g/mol |
| 10a |
| b |
| 10a |
| b |
| 10g |
| 20g/mol |


 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3 和NaOH |
| B、Na2CO3和HCl |
| C、NaHCO3和HCl |
| D、NaAlO2和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5:1 | B、1:4 |
| C、4:1 | D、1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氯离子的结构示意图: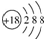 | ||
| B、明矾的化学式:KAl(SO4)2 | ||
C、中子数为10的氧原子:
| ||
D、溴化铵的电子式: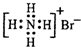 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl+NaOH═NaCl+NH3?H2O |
| B、Mg(OH)2+2HCl═MgCl2+2H2O |
| C、NaOH+NaHCO3═Na2CO3+H2O |
| D、NaOH+HNO3═NaNO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
| B | NaOH | HCl | NH4Cl | Na2O | CO |
| C | NH3?H2O | CH3COOH | NaCl | Na2O2 | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
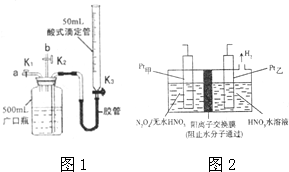
查看答案和解析>>
科目:高中化学 来源: 题型:
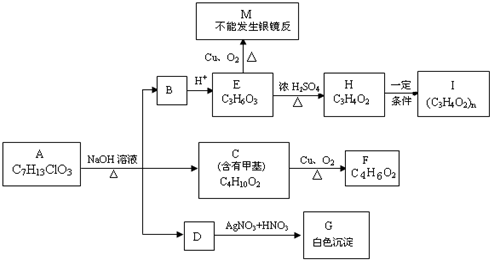
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com