
【题目】下列反应属于吸热反应的是( )
A.稀硫酸与氢氧化钾溶液反应B.氢气还原氧化铜的反应
C.锌与稀硫酸的反应D.生石灰变成熟石灰的反应
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,下列叙述中不正确的是( )
A. 0.1 mol/L 的 CH3COOH 溶液中加水稀释,溶液中所有离子浓度均减小
B. 醋酸溶液中离子浓度的关系满足:c(H+) = c(CH3COO-) + c(OH- )
C. CH3COOH 溶液中加入少量 CH3COONa(s),平衡逆向移动
D. 常温下,pH = 2 的 CH3COOH 溶液与 pH = 12 的 NaOH 溶液等体积混合后,溶液的 pH < 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可按下面框图进行反应。又知D溶液为黄色,E溶液为无色,请回答:
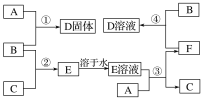
(1)A是__________,B是__________,C是_______________(填写化学式)。
(2)反应①的化学方程式为_______________________________。
(3)反应③的化学方程式为________________________________________。
(4)反应④的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或叙述正确的是
A. 已知HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3kJ·mol-1
B. 500℃、30 MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热46.2 kJ
2NH3(g) ΔH=-92.4 kJ·mol-1将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热46.2 kJ
C. 已知氢气的燃烧热为286 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g) ΔH=+572 kJ·mol-1
D. 甲烷的燃烧热为890.3 kJ·mol-1,则表示甲烷燃烧热的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应2Al+6HCl=2AlCl3+3H2中:
(1)该反应被氧化的元素是______,被还原的元素是_______(填元素符号)。
(2)该反应中氧化剂是________,还原剂是________(填元素符号)。
(3)若反应中转移电子3mol,则在反应中消耗Al________mol。
(4)用双线桥法表示下列反应的电子转移情况:________。
Zn + 2HCl = ZnCl2+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,①6.72L NH3 ②1.204×1023个H2S ③5.6g CH4 ④0.5mol HCl ,下列关系正确的是( )
A. 体积大小:④>③>②>①B. 原子数目:③>①>②>④
C. 密度大小:④>②>③>①D. 质量大小:④>②>③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.化学电源在生产生活中有着广泛的应用,电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
(1)写出放电时负极的电极反应式:______________________________;
(2)铅蓄电池放电时,溶液的pH将_________(填“增大”、“减小”或“不变”)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________。
(3)放电完后,对该电池进行充电,在连接电源的负极一端生成________。(填“Pb”或“PbO2”)
Ⅱ.光气(COCl2)是一种重要化工原料,常用于聚酯类材料的生产,工业上通过Cl2(g)+CO(g)![]() COCl2(g) △H < 0制备。下图为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g) △H < 0制备。下图为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:

(4)0~6min内,反应的平均速率v(Cl2)=________________;
(5)该反应第一次达平衡时的平衡常数为_________________,10min改变的条件是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com