
°ĺŐ‚ńŅ°ŅŌ¬Ń–»»ĽĮ—ß∑Ĺ≥Ő ĹĽÚ–ū Ų’ż»∑Ķń «
A. “—÷™HClļÕNaOH∑ī”¶Ķń÷–ļÕ»»¶§H£Ĺ-57.3 kJ°§mol£≠1£¨‘ÚCH3COOH(aq)£ęNaOH(aq)=CH3COONa(aq)£ęH2O(l) ¶§H£Ĺ-57.3kJ°§mol£≠1
B. 500°ś°Ę30 MPaŌ¬£¨N2(g)£ę3H2(g)![]() 2NH3(g) ¶§H£Ĺ-92.4 kJ°§mol£≠1Ĺę0.5 mol N2(g)ļÕ1.5 mol H2(g)÷√”ŕ√‹Ī’»›∆ų÷–≥š∑÷∑ī”¶…ķ≥…NH3(g)∑Ň»»46.2 kJ
2NH3(g) ¶§H£Ĺ-92.4 kJ°§mol£≠1Ĺę0.5 mol N2(g)ļÕ1.5 mol H2(g)÷√”ŕ√‹Ī’»›∆ų÷–≥š∑÷∑ī”¶…ķ≥…NH3(g)∑Ň»»46.2 kJ
C. “—÷™«‚∆ÝĶń»ľ…’»»ő™286 kJ°§mol£≠1£¨‘Ú2H2O(g)===2H2(g)£ęO2(g)°°¶§H£Ĺ£ę572 kJ°§mol£≠1
D. ľ◊ÕťĶń»ľ…’»»ő™890.3 kJ°§mol£≠1£¨‘ÚĪŪ ĺľ◊Õť»ľ…’»»Ķń»»ĽĮ—ß∑Ĺ≥Ő ĹŅ…ĪŪ ĺő™CH4(g)£ę2O2(g)£ĹCO2(g)£ę2H2O(l)°°¶§H£Ĺ£≠890.3 kJ°§mol£≠1
°ĺīūįł°ŅD
°ĺĹ‚őŲ°Ņ
A.»űňŠĶÁņŽĻż≥Ő“™őŁ ’≤Ņ∑÷»»ŃŅ£Ľ
B.Ķ™∆ÝļÕ«‚∆ÝĶńŃŅĪ»∑ī”¶«į≥…Ī»ņżľű–°Ļż≥Ő£¨ŌŗĶĪ”ŕľű—ĻĻż≥Ő£¨∆Ĺļ‚ŌÚ◊ů“∆∂Į£Ľ
C. »ľ…’»»÷ł…ķ≥…ő»∂®ĽĮļŌőÔ£¨ňģő™“ļŐ¨£Ľ
D. »ľ…’»»÷ł…ķ≥…ő»∂®ĽĮļŌőÔ£¨ňģő™“ļŐ¨£¨∂Ģ—űĽĮŐľő™∆ÝŐ¨£Ľ
A. CH3COOHő™»űĶÁĹ‚÷ £¨ĶÁņŽĻż≥ŐőŁ»»£¨ňý“‘CH3COOH(aq)£ęNaOH(aq)=CH3COONa(aq)£ęH2O(l) ¶§H>-57.3kJ°§mol£≠1£¨AīŪőů£Ľ
B. ∑ī”¶ŌŻļń1 mol N2(g)ļÕ3 mol H2£¨∑Ň»»92.4 kJ£ĽŌ÷Ĺę0.5 mol N2(g)ļÕ1.5 mol H2(g)÷√”ŕ√‹Ī’»›∆ų÷–≥š∑÷∑ī”¶…ķ≥…NH3(g)ĶńĻż≥Ő£¨Ķ»–ß”ŕľű—ĻĶńĻż≥Ő£¨∆Ĺļ‚◊ů“∆£¨∑Ň≥ŲĶń»»ŃŅ–°”ŕ46.2 kJ£¨BīŪőů£Ľ
C. «‚∆ÝĶń»ľ…’»»÷łĶń «1mol«‚∆ÝÕͻ껾…’…ķ≥…“ļŐ¨ňģ∑Ň»»286 kJ°§mol£≠1£¨ňý“‘2H2O(l)===2H2(g)£ęO2(g)°°¶§H£Ĺ£ę572 kJ°§mol£≠1£¨‘Ú2H2O(g)===2H2(g)£ęO2(g)°°¶§H<£ę572 kJ°§mol£≠1£¨CīŪőů£Ľ
D. ľ◊ÕťĶń»ľ…’»»÷łĶń «1molľ◊Õť∆ÝŐŚÕͻ껾…’…ķ≥…“ļŐ¨ňģ∑Ň»»ő™890.3 kJ£¨‘ÚĪŪ ĺľ◊Õť»ľ…’»»Ķń»»ĽĮ—ß∑Ĺ≥Ő ĹŅ…ĪŪ ĺő™CH4(g)£ę2O2(g)£ĹCO2(g)£ę2H2O(l)°°¶§H£Ĺ£≠890.3 kJ°§mol£≠1£¨D’ż»∑£Ľ
◊Ř…Ōňý Ų£¨ĪĺŐ‚—°D°£



| ńÍľ∂ | łŖ÷–Ņő≥Ő | ńÍľ∂ | ≥ű÷–Ņő≥Ő |
| łŖ“Ľ | łŖ“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű“Ľ | ≥ű“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ∂Ģ | łŖ∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű∂Ģ | ≥ű∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ»ż | łŖ»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű»ż | ≥ű»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° |
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ‘ŕ…ķ≥…ļÕīŅĽĮ““ňŠ““ű•Ķń Ķ—ťĻż≥Ő÷–£¨Ō¬Ń–≤Ŕ◊ų÷–ń©…śľįĶń «
A. 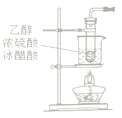 B.
B.  C.
C. 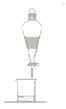 D.
D. 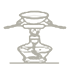
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņő™∑ņ÷őĶ‚»Ī∑¶≤°£¨Õ®≥£‘ŕ ≥—ő÷–ŐŪľ”…ŔŃŅĶńĶ‚ňŠľō(KIO3)°£Ķ‚ňŠľōļÕĶ‚ĽĮľō‘໋“ļ÷–ń‹∑Ę…ķŌ¬Ń–∑ī”¶£ļKIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
£®1£©ł√∑ī”¶÷–£¨—űĽĮľŃ «________£¨—űĽĮ≤ķőÔ «_____°£
£®2£©ĶĪ”–3mol I2…ķ≥… Ī£¨”–______molĽĻ‘≠ľŃĪĽ—űĽĮ°£
£®3£©ĶĪ”–1mol—űĽĮľŃ≤ő”Ž∑ī”¶ Ī£¨◊™“∆ĶÁ◊”ĶńőÔ÷ ĶńŃŅő™_____mol°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ‘ŕ“Ľ∂®ŐŚĽżĶń√‹Ī’»›∆ų÷–£¨ĹÝ––»ÁŌ¬ĽĮ—ß∑ī”¶£ļCO2£®g£©£ęH2£®g£©![]() CO£®g£©£ęH2O£®g£©£¨
CO£®g£©£ęH2O£®g£©£¨
∆šĽĮ—ß∆Ĺļ‚≥£ żKļÕő¬∂»tĶńĻōŌĶ»ÁŌ¬ĪŪ£ļ
t°ś | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
ĽōīūŌ¬Ń–ő Ő‚£ļ
£®1£©ł√∑ī”¶ĶńĽĮ—ß∆Ĺļ‚≥£ żĪŪīÔ Ĺő™K =__________________°£
£®2£©ł√∑ī”¶ő™__________∑ī”¶£®°įőŁ»»°ĪĽÚ°į∑Ň»»°Ī£©°£
£®3£©ń‹Ň–∂Ōł√∑ī”¶ «∑ŮīÔĶĹĽĮ—ß∆Ĺļ‚◊īŐ¨Ķń“ņĺ› «_______________°£
a£ģ»›∆ų÷–—Ļ«Ņ≤ĽĪš b£ģĽžļŌ∆ÝŐŚ÷– c£®CO£©≤ĽĪš
c£ģ¶‘’ż£®H2£©£Ĺ¶‘ńś£®H2O£© d£ģc£®CO2£©£Ĺc£®CO£©
£®4£©ń≥ő¬∂»Ō¬£¨∆Ĺļ‚Ň®∂»∑ŻļŌŌ¬ Ĺ£ļc£®CO2£©°§c£®H2£©£Ĺc£®CO£©°§c£®H2O£©£¨ ‘Ň–∂Ōīň ĪĶńő¬∂»ő™________°ś°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń–Ĺ‚ Õ ¬ ĶĶńņŽ◊”∑Ĺ≥Ő Ĺ≤Ľ’ż»∑Ķń «
A. ¬Ń∆¨∑Ň»ŽNaOH»‹“ļ÷–”–∆ÝŐŚ≤ķ…ķ£ļ2Al + 2OH£≠+ 2H2O===2AlO2£≠+3H2°Ł
B. ŌÚK2Cr2O7»‹“ļ÷–Ķőľ”…ŔŃŅŇ®H2SO4£¨»‹“ļ≥»…ęľ”…Ó£ļ Cr2O72£≠(≥»…ę) + H2O![]() 2CrO42£≠(Ľ∆…ę) + 2H+
2CrO42£≠(Ľ∆…ę) + 2H+
C. ŌÚNa2SiO3»‹“ļ÷–Õ®»ŽĻżŃŅCO2÷∆ĪłĻŤňŠńżĹļ£ļSiO32£≠+ CO2 + H2O===H2SiO3£®ĹļŐŚ£©+ CO32£≠
D. ”√Na2CO3»‹“ļĹĢŇ›ĻݬĮňģĻł£®ļ¨CaSO4£©£ļCaSO4 + CO32£≠![]() CaCO3 + SO42£≠
CaCO3 + SO42£≠
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń–∑ī”¶ Ű”ŕőŁ»»∑ī”¶Ķń «£® £©
A.Ō°ŃÚňŠ”Ž«‚—űĽĮľō»‹“ļ∑ī”¶B.«‚∆ÝĽĻ‘≠—űĽĮÕ≠Ķń∑ī”¶
C.–Ņ”ŽŌ°ŃÚňŠĶń∑ī”¶D.…ķ ĮĽ“Īš≥… ž ĮĽ“Ķń∑ī”¶
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ“ż∆ūĽĮ—ß∆Ĺļ‚“∆∂ĮĶńłýĪĺ‘≠“Ú «£® £©
A.Ň®∂»ĶńłńĪšB.—Ļ«ŅĶńłńĪš
C. Ļ”√ŃňīŖĽĮľŃD.’żńś∑ī”¶ňŔ¬ ĻōŌĶĶńłńĪš
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅPEI [ ] «“Ľ÷÷∑«ĹŠĺß–‘ň‹ŃŌ°£∆šļŌ≥…¬∑ŌŖ»ÁŌ¬£®ń≥–©∑ī”¶ŐűľĢļÕ ‘ľŃ“—¬‘»•£©£ļ
] «“Ľ÷÷∑«ĹŠĺß–‘ň‹ŃŌ°£∆šļŌ≥…¬∑ŌŖ»ÁŌ¬£®ń≥–©∑ī”¶ŐűľĢļÕ ‘ľŃ“—¬‘»•£©£ļ

“—÷™£ļ
£®1£©Aő™Ńī◊īŐĢ°£AĶńĽĮ—ß√Ż≥∆ő™______°£
£®2£©A°ķBĶń∑ī”¶ņŗ–Õő™______°£
£®3£©Ō¬Ń–Ļō”ŕDĶńňĶ∑®÷–’ż»∑Ķń «______£®ŐÓ◊÷ńł£©°£
a£ģ≤Ľīś‘ŕŐľŐľň꾣
b£ģŅ…◊ųĺŘļŌőÔĶńĶ•ŐŚ
c£ģ≥£ő¬Ō¬ń‹”ŽňģĽž»‹
£®4£©F”…4-¬»-1£¨2-∂Ģľ◊ĪĹīŖĽĮ—űĽĮ÷∆Ķ√°£Fňýļ¨ĻŔń‹ÕŇ”–£≠ClļÕ______°£
£®5£©CĶńļňīŇĻ≤’Ů«‚∆◊÷–£¨÷Ľ”–“ĽłŲőŁ ’∑Ś°£ĹŲ“‘2-šŚĪŻÕťő™”–Ľķ‘≠ŃŌ£¨—°”√Īō“™ĶńőřĽķ ‘ľŃ“≤ń‹ļŌ≥…C–ī≥Ų”–ĻōĽĮ—ß∑Ĺ≥Ő Ĺ£ļ______°£
£®6£©F°ķK Ķń∑ī”¶Ļż≥Ő÷–”–∂ŗ÷÷łĪ≤ķőÔ°£∆š÷–“Ľ÷÷ļ¨”–3łŲĽ∑Ķń”–ĽķőÔĶńĹŠĻĻľÚ Ĺ «___°£
£®7£©“‘EļÕKő™‘≠ŃŌļŌ≥…PEI∑÷ő™»ż≤Ĺ∑ī”¶°£

–ī≥Ų÷–ľš≤ķőÔ1°Ę÷–ľš≤ķőÔ2ĶńĹŠĻĻľÚ Ĺ£ļ______°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ”√NAĪŪ ĺįĘ∑ŁŔ§Ķ¬¬ř≥£ ż÷Ķ£¨Ō¬Ń––ū Ų÷–’ż»∑Ķń «
A. 5.6gŐķ‘ŕ◊„ŃŅĶńO2÷–»ľ…’£¨◊™“∆ĶńĶÁ◊” żő™0.3NA
B. 18g H218OļÕD2OĶńĽžļŌőÔ÷–£¨ňýļ¨÷–◊” żő™9NA
C. 1.0 mol CH4”ŽCl2‘ŕĻ‚’’Ō¬∑ī”¶…ķ≥…ĶńCH3Cl∑÷◊” żő™1.0NA
D. 0.4 mol NH3”Ž0.6 mol O2‘ŕīŖĽĮľŃĶń◊ų”√Ō¬≥š∑÷∑ī”¶£¨Ķ√ĶĹNOĶń∑÷◊” żő™0.4NA
≤ťŅīīūįłļÕĹ‚őŲ>>
Ļķľ —ß–£”Ň—° - Ń∑Ōį≤ŠŃ–ĪŪ - ‘Ő‚Ń–ĪŪ
ļĢĪĪ °Ľ•Ń™ÕÝő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®∆ĹŐ® | ÕÝ…Ō”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | ĶÁ–Ň’©∆≠ĺŔĪ®◊®«Ý | …śņķ ∑–ťőř÷ų“Ś”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | …ś∆ů«÷»®ĺŔĪ®◊®«Ý
ő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®ĶÁĽį£ļ027-86699610 ĺŔĪ®” Ōš£ļ58377363@163.com